题目内容
I、已知反应:
3I-(aq)+S2O82-(aq) ![]() I3-(aq)+2SO42-(aq);
I3-(aq)+2SO42-(aq);
(1)写出反应的平衡常数表达式
 K= 。
K= 。
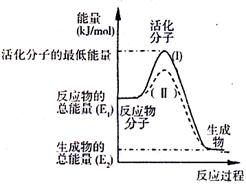
(2)右图表示反应过程中有关物质的能量,则反应
的 △H 0(填>、<、=)。
(I)、(II)两线中,使用催化剂的是 线。
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 。
(4)反应的速率可以用I3-与加入的淀粉溶液反应是蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-/mol·L-1) | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
则:该实验的目的是
显色时间t1= s
分析表中数据,得出的结论是
II、二氧化硫和氮的氧化物是常用的化工原料,但也是大气的主要污染物。综合治理其污染是环境化学当前的重要研究内容之一。
硫酸生产中,SO2催化氧化生成SO3:2SO2(g)+O2(g) ![]() 2SO3(g)
2SO3(g)
某温度下,SO2的平衡转化率(α)与体系总压强(p)的关系如右图所示。
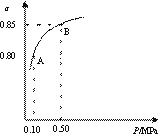 根据图示回答下列问题。
根据图示回答下列问题。
①平衡状态由A变到B时,平衡常数K(A) K(B)
(填“>”、“<”、“=”)。
②已知上述反应的是放热反应,当该反应处于平衡状态时,
在体积不变的条件下,下列选项中有利于提高SO2平衡转
化率的有 (填字母)。
A.升高温度 B.降低温度 C.增大压强 D.减小压强
E.加入催化剂 F.移出氧气
I、
(1)![]()
(2)<,(II)
(3)3:2
(4)研究I-、S2O82-浓度对反应速率的影响;22;反应速率与反应物浓度乘积成正比。
II、 (1)①= ②B、C

 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案(10分)已知反应:3I-(aq)+S2O82-(aq) I3-(aq)+2SO42- (aq)
I3-(aq)+2SO42- (aq)
(1)写出反应的平衡常数表达式K= ;
(2)右图表示反应过程中有关物质的能量,则反应的 0(填“>”、“<”或“=”);
0(填“>”、“<”或“=”);
(Ⅰ)、(Ⅱ)两线中,使用催化剂的是 线;
(3)反应中发生反应的I-与被氧化的I-的物质的量比为 ;
(4)反应的速率可以用 与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。某探究性学习小组在20℃进行实验,记录的数据如下:
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol·L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
c( )/mol·L-1 )/mol·L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
已知反应:3I-(aq)+S2O82-(aq)  I3-(aq)+2SO42-(aq)+Q
I3-(aq)+2SO42-(aq)+Q
(1)写出反应的平衡常数表达式:K= 。
(2)如图表示反应过程中有关物质的能量,则反应过程中的Q 0(填>、<、=);(I)、(II)两曲线中,使用催化剂的是 曲线。

(3)反应的速率可以用I3-与加入的淀粉溶液反应显蓝色的时间t来度量,t越小,反应速率越大。下表是在20℃进行实验时所记录的数据
|
实验编号 |
① |
② |
③ |
④ |
⑤ |
|
c(I-)/mol·L-1 |
0.040 |
0.080 |
0.080 |
0.160 |
0.160 |
|
c(S2O82-)/mol·L-1 |
0.040 |
0.040 |
0.080 |
0.080 |
0.040 |
|
t/s |
88 |
44 |
22 |
11 |
t1 |
从表中数据分析,该实验的目的是 ;
表中显色时间t1= s;最终得出的结论是 。
 已知反应:3I-(aq)+
已知反应:3I-(aq)+