题目内容
有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
第一组 | He -268.8 | (a) -249.5 | Ar -185.8 | Kr -151.7 |
第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
第三组 | (c) 19.4 | HCl -84.0 | HBr -67.0 | HI -35.3 |
第四组 | H2O 100.0 | H2S -60.2 | (d) 42.0 | H2Te -1.8 |
下列各项判断正确的是
A.abc的化学式分别为Ne2、Br2、HF
B.第三组与第四组相比较,化合物的稳定顺序为:HBr>d
C.第三组物质溶于水后,溶液的酸性:c>HCl>HBr>HI
D.第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键
B

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目
有4组同一族元素所形成的不同物质,在101kPa时测定它们的沸点(℃)如下表所示:
下列各项判断正确的是( )
| 第一组 | He-268.8 | (a)-249.5 | Ar-185.8 | Kr-151.7 |
| 第二组 | F2 -187.0 | Cl2 -33.6 | (b) 58.7 | I2 184.0 |
| 第三组 | (c) 19.4 | HCl-84.0 | HBr-67.0 | HI-35.3 |
| 第四组 | H2O 100.0 | H2S-60.2 | (d) 42.0 | H2Te-1.8 |
| A、abc的化学式分别为Ne2、Br2、HF |
| B、第三组与第四组相比较,化合物的稳定顺序为:HBr>d |
| C、第三组物质溶于水后,溶液的酸性:c>HCl>HBr>HI |
| D、第四组物质中H2O的沸点最高,是因为H2O分子内存在氢键 |
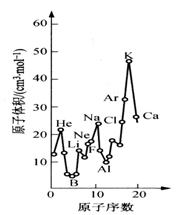 (1)第二周期原子体积最大的元素形成的固态单质属于
(1)第二周期原子体积最大的元素形成的固态单质属于