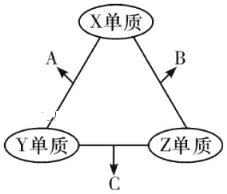
题目内容
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工艺流程如下图所示:

(1)化合物Li2Ti5O15中钛元素的化合价是+4价,氧元素的化合价为__________。
(2)钛铁矿与硫酸反应时,常将钛铁矿粉碎,其目的是:__________,滤渣A的成分是__________。
(3)固体TiO2转化(NH4)2Ti5O15的离子方程式为__________,该反应__________氧化还原反应 (填“属于” 或“不属于” )。
(4)反应②中固体TiO2、转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图所示。反应温度过高时,Ti 元素浸出率下降的原因是__________。

(5)(NH4)2Ti5O15转化为Li2Ti5O15的离子方程式为:__________。
(6)写出由滤液D生成FePO4的离子方程式__________。
(7)由滤液D制各LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是__________。
【答案】 -2、-1 增大接触面积加快反应速率,提高浸出率 SiO2 CaSO4 5TiO2+4H2O2+2NH3·H2O=2NH4++Ti5O152-+5H2O 不属于 温度过高时,反应物氨水(或双氧水)会受热分解 Ti5O152-+2Li+=Li2Ti5O15↓ 2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+ 20∶9
【解析】铁矿石加入硫酸溶解过滤得到滤渣A为二氧化硅和硫酸钙,滤液B中含有Mg2+、Fe2+、Ti4+等,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4。
(1)化合物Li2Ti5O15中钛元素的化合价是+4价,Li元素的化合价为+1价,根据正负化合价的代数和为0,氧元素的化合价为-2、-1,故答案为:-2、-1;
(2)钛铁矿与硫酸反应时,常将钛铁矿粉碎,可以增大接触面积加快反应速率,提高浸出率,由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,故答案为:增大接触面积加快反应速率,提高浸出率;SiO2 、CaSO4;
(3) 二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15的离子方程式为5TiO2+4H2O2+2NH3·H2O=2NH4++Ti5O152-+5H2O,反应中没有元素的化合价发生变化,不属于氧化还原反应,故答案为:5TiO2+4H2O2+2NH3·H2O=2NH4++Ti5O152-+5H2O;不属于;
(4)由于二氧化钛与氨水、双氧水反应生成(NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5) (NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15,反应的离子方程式为Ti5O152-+2Li+=Li2Ti5O15↓,故答案为:Ti5O152-+2Li+=Li2Ti5O15↓;
(6)过氧化氢将Fe2+氧化为Fe3+,加入磷酸得到沉淀磷酸铁,反应离子方程式为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+,故答案为:2Fe2++2H3PO4+H2O2=2FePO4↓+2H2O+4H+;
(7)根据电子守恒,过氧化氢氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,则:
H2O2~H2C2O4
34 90
x×17% y
所以![]() =
=![]() ,整理可得x:y=20:9,17%双氧水与H2C2O4的质量比为20:9,故答案为:20:9。
,整理可得x:y=20:9,17%双氧水与H2C2O4的质量比为20:9,故答案为:20:9。

 名校课堂系列答案
名校课堂系列答案【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验。
实验Ⅰ 反应产物的定性探究
实验装置如图所示。![]() 固定装置已略去
固定装置已略去![]()
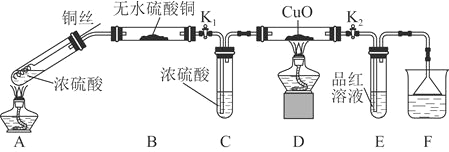
(1)A中反应的化学方程式为____________。
(2)F烧杯中的溶液通常是________________。
(3)实验过程中,能证明浓硫酸中硫元素的氧化性强于氢元素的现象是______。
(4)实验结束后,证明A装置试管中反应所得产物是否含有铜离子的操作方法是______。
(5)为说明浓硫酸中的水是否影响B装置现象的判断,还须进行一次实验。实验方案为_______。
实验Ⅱ 反应产物的定量探究
(6)在铜与浓硫酸反应的过程中,发现有黑色物质出现,经查阅文献获得下列资料。
资料1:
硫酸(mol/L) | 黑色物质出现的温度(℃) | 黑色物质消失的温度(℃) |
15 | 约150 | 约236 |
16 | 约140 | 约250 |
18 | 约120 | 不消失 |
资料2:X射线晶体分析表明,铜与浓硫酸反应生成的黑色物质为Cu2S、CuS、Cu7S4中的一种或几种。仅由上述资料可得出的正确结论是_________。
a.铜与浓硫酸反应时所涉及的反应可能不止一个
b.硫酸浓度选择适当,可避免最后产物中出现黑色物质
c.该反应发生的条件之一是硫酸浓度≥15mol/L
d.硫酸浓度越大,黑色物质越快出现、越难消失
(7)为测出硫酸铜的产率,将该反应所得溶液中和后配制成250.00mL溶液,取该溶液25.00mL加入足量KI溶液振荡,以淀粉溶液为指示剂,用bmol/LNa2S2O3溶液滴定生成的I2,3次实验平均消耗该Na2S2O3溶液V mL。若反应消耗铜的质量为a g,则硫酸铜的产率为________。(已知:2Cu2++4I-=2CuI+I2,2S2O32-+I2=S4O62-+2I-)