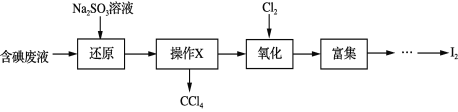
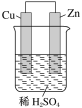
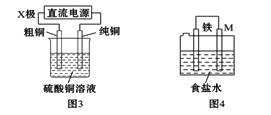
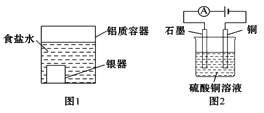
题目内容
【题目】下列判断正确的是:
A. NaHCO3溶液中滴加少量Ba(OH)2溶液反应的离子方程式为:HCO3-+OH-+Ba2+==BaCO3↓+H2O
B. 钠与水反应的离子方程式为:Na+H2O===Na++OH-+H2↑
C. HS-的电离方程式为:HS-+H2O![]() H2S+OH-
H2S+OH-
D. c(H+)=1.0mol/L的溶液中Na+、Al3+、NO![]() 、I-不能大量共存
、I-不能大量共存
【答案】D
【解析】
A.结合HCO3-与OH-的反应实质,以及反应物用量进行分析;
B.将Na与水的化学反应方程式拆写成离子反应方程式;
C.HS-+H2O![]() H2S+OH-为HS-的水解方程式;
H2S+OH-为HS-的水解方程式;
D.酸性条件下,硝酸根与碘离子发生氧化还原反应不共存;
A.NaHCO3溶液中滴加少量Ba(OH)2溶液反应的离子方程式为:2HCO3-+2OH-+Ba2+==BaCO3↓+H2O+ CO32-,故A项错误;
B.钠与水反应的离子方程式为:2Na+2H2O =2Na++2OH-+H2↑,故B项错误;
C.HS-的电离方程式为:HS-+H2O![]() S2-+H+,故C项错误;
S2-+H+,故C项错误;
D.c(H+)=1.0mol/L的溶液呈现酸性,酸性条件下,硝酸可以氧化I-,不能大量共存,故D项正确;
综上,本题选D。

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案【题目】下列预测某些碱金属元素及其化合物的性质的结论错误的是( )
选项 | 已知某些碱金属元素及其单质的性质 | 预测某些碱金属元素及其单质的性质 |
A | 锂、钠、钾三种元素在自然界中都以化合态存在 | 铷元素和铯元素在自然界中都以化合态存在 |
B | 钾单质与空气中的氧气反应比钠单质更剧烈,甚至能燃烧 | 铷单质和铯单质比钾单质更容易与氧气反应,遇到空气就会立即燃烧 |
C | 钾单质与水反应比钠单质更剧烈,甚至爆炸 | 铷和铯比钾更容易与水反应,遇水立即燃烧,甚至爆炸 |
D | 锂元素和钠元素在化合物中的化合价都是 | 锂单质与氧气反应生成的氧化物有 |
A. AB. BC. CD. D