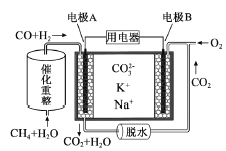
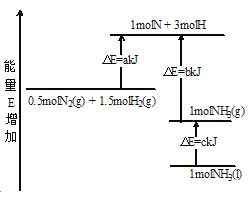
��Ŀ����
����Ŀ���ں����ܱ������У���10 mol CO��һ������H2S��ϼ��Ȳ��ﵽ����ƽ�⣺CO(g)��H2S(g) ![]() COS(g)��H2(g) K��1��ƽ���CO���ʵ���Ϊ8 mol������˵����ȷ����
COS(g)��H2(g) K��1��ƽ���CO���ʵ���Ϊ8 mol������˵����ȷ����
A. CO��H2S��ת����֮��Ϊ1:1
B. ��ƽ���H2S���������Ϊ4%
C. �����¶ȣ�COSŨ�ȼ�С�������÷�Ӧ�����ȷ�Ӧ
D. ��������ƽ����ϵ���ټ���CO��H2S��COS��H2��1 mol��ƽ�ⲻ�ƶ�
���𰸡�B
��������
��ӦǰCO�����ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol���跴ӦǰH2S���ʵ���Ϊn����
CO(g)��H2S(g) ![]() COS(g)��H2(g)
COS(g)��H2(g)
��ʼ��mol����10 n 0 0
�仯��mol����2 2 2 2
ƽ�⣨mol����8 n-2 2 2
���¶��¸÷�Ӧ��K=1���������ʵ�������Ũ�ȴ���ƽ�ⳣ������ʽ�����n�����ݼ���������ѧƽ���Ӱ�����ؽ����ж���
��ӦǰCO�����ʵ���Ϊ10mol��ƽ���CO���ʵ���Ϊ8mol���跴ӦǰH2S���ʵ���Ϊn����
CO(g)��H2S(g) ![]() COS(g)��H2(g)
COS(g)��H2(g)
��ʼ��mol����10 n 0 0
�仯��mol����2 2 2 2
ƽ�⣨mol����8 n-2 2 2
���¶��¸÷�Ӧ��K=1���������ݻ�ΪV����ƽ�ⳣ��K=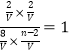 ��
��
��ã�n=2.5������Ӧǰ��������ʵ���Ϊ2.5mol��
A�����ڷ�ӦǰCO��H2S�����ʵ����ֱ�Ϊ10mol��2.5mol��������ѧ��������ȣ���Ӧ���ĵ����ʵ�����ȣ����Զ��ߵ�ת����һ������ȣ���A����
B���÷�Ӧǰ������������ȣ���Ӧ������������ʵ������䣬��ȻΪ10mol+2.5mol=12.5mol��ƽ�����������ʵ���Ϊ��2.5-2��mol=0.5mol����ͬ������������������=���ʵ�������=0.5mol/12.5mol��100%=4.0%����B��ȷ��
C�������¶ȣ�COSŨ�ȼ�С��˵��ƽ�����������ƶ�����÷�Ӧ������ӦΪ���ȷ�Ӧ����C����
D����������ƽ����ϵ���ټ���CO��H2S��COS��H2��1 mol�����ʱ�÷�Ӧ��Ũ����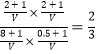 <1��˵��ƽ������������ƶ�����D������
<1��˵��ƽ������������ƶ�����D������
��ѡB��

 �������ͬ����ϰϵ�д�
�������ͬ����ϰϵ�д�����Ŀ�����ڲ��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ���±���
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
X | �����������Ǵ�����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ��ӣ����⻯��ˮ��Һ�ʼ��� |
T | M������6������ |
Z | Ԫ�����������+7�� |
W | �䵥�ʼ��ܸ��ᷴӦ�����ܸ��Ӧ��������H2 |
����Ӧ��Ԫ�ط��Ż�ѧʽ�ش���������
��1��Ԫ��X��һ��ͬλ������������������1������ͬλ�صķ�����______��
��2��Ԫ��Y����Ԫ���γ�һ������YH4+��д�������ĵ���ʽ______��
��3��Ԫ��Z��Ԫ��T��ȣ��ǽ�����ǿ����______����Ԫ�ط��ű�ʾ����
��4��T��X��Y��Z����Ԫ�ص�����������Ӧ��ˮ������������ǿ����______����ѧʽ��
��5��T������������Ӧ��ˮ������W������������Ӧ��ˮ���ﷴӦ�����ӷ���ʽΪ______��
����Ŀ�����Ϊ�١����Ԫ�أ���Ԫ�����ڱ��е�λ�����£�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0�� |
1 | �� | �� | ||||||
2 | �� | �� | �� | �� | ||||
3 | �� | �� | �� | �� |
�Իش��������⣺
��1��(��дԪ�ط���)�� _____��______��_____ ��_____
��2���ٺܺ͢�Ԫ���γɵĻ�����Ļ�ѧʽ________���õ���ʽ��ʾ���γɹ���Ϊ__________��
��3���ߺ͢��Ԫ�ص�����������ˮ����ļ����ǣ� ______��_________ ���ѧʽ������͢��Ԫ�ص�����������ˮ����������ǣ� ______ ��_________ ���ѧʽ����
��4���١��ݡ��ߺ�Ԫ���γɵ�һ�ֻ�����ĵ���ʽ��________���ڸû������мȺ���________�����ֺ���________����