题目内容
【题目】用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧。
(1)由上述实验现象所得出的有关过氧化钠跟水反应的结论是:①有氧气生成;②____________。Na2O2跟水反应的化学方程式是____________。
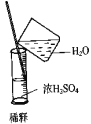
(2)某研究性学习小组拟用如图所示装置(气密性良好)进行实验,以证明上述结论。用以验证第一条结论的实验方法是_________;用以验证第二条结论的实验方法是________。

(3)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为____。
(4)将Cl2制成漂白粉的主要目的是________(填字母)。
A.增强漂白能力和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.提高氯的质量分数,有利于漂白、消毒
(5)将漂白粉溶于适量水中,呈白色浊状物,静置沉降。取少许上层清液,滴加碳酸钠溶液出现白色沉淀,发生反应的化学方程式为_________。
(6)瓶装漂白粉久置空气中会呈稀粥状而失去漂白作用。试用化学方程式表示漂白粉在空气中易失效的原因是①_____________;②__________。
【答案】该反应是放热反应 2Na2O2+2H2O===4NaOH+O2↑ 关闭止水夹,将带火星的木条靠近导管口p处,木条复燃 反应停止后,将导管口q浸入水中,打开止水夹,q处有气泡冒出 2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O B Ca(ClO)2+Na2CO3===CaCO3↓+2NaClO CaCl2+Na2CO3===CaCO3↓+2NaCl Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO 2HClO![]() 2HCl+O2↑
2HCl+O2↑
【解析】
(1)往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,说明过氧化钠与水反应放出热量,结合质量守恒定律可知生成NaOH和氧气;
(2)用A图所示装置进行实验,生成氧气具有助燃性,放热使锥形瓶内气体压强增大;
(3)氯气与石灰乳反应会生成氯化钙、次氯酸钙和水;
(4)氯气有毒,气体不方便运输、销售,为了方便人们日常使用和运输,需要制成固体,并减低对人体的毒害;
(5)上层清液中含氯化钙与次氯酸钙,均会与碳酸钠生成碳酸钙沉淀;
(6)次氯酸钙会与空气中二氧化碳与水反应生成易分解的次氯酸。
(1)往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来,可知反应生成氧气,且反应放出热量,是放热反应;发生的反应为2Na2O2+2H2O=4NaOH+O2↑,
故答案为:该反应是放热反应;2Na2O2+2H2O===4NaOH+O2↑;
(2)用A图所示装置进行实验,验证第一条结论的实验方法是关闭止水夹,将带火星的木条靠近导管口p处,木条复燃,用以验证第二条结论的实验方法是反应停止后,将导管口q浸入水中,打开止水夹,q处有气泡冒出
故答案为:关闭止水夹,将带火星的木条靠近导管口p处,木条复燃 反应停止后,将导管口q浸入水中,打开止水夹,q处有气泡冒出;
(3)氯气通入石灰乳[Ca(OH)2]制取漂白粉的化学方程式为:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
(4)A. 将Cl2制成漂粉精,漂白和消毒作用效果不会改变,A项错误;
B. 氯气有毒,气体不方便运输、销售,制成漂粉精是一种较稳定物质,便于保存和运输,B项正确;
C. 将Cl2制成漂粉精是为了将气体转化为固体,便于保存和运输,C项错误;
D. 将Cl2制成漂粉精,其中氯元素的质量不变,漂白和消毒作用效果不会改变,D项错误;
答案选B。
(5)将漂白粉溶于水中,上层清液中会存在钙离子、氯离子和次氯酸根离子,因此滴加碳酸钠溶液出现白色沉淀,发生反应的化学方程式为:Ca(ClO)2+Na2CO3===CaCO3↓+2NaClO;CaCl2+Na2CO3===CaCO3↓+2NaCl;
(6)由于碳酸的酸性强于次氯酸,因此久置的漂白粉会与空气中的二氧化碳和水反应,生成的次氯酸易分解,因此失效,反应的化学方程式为:①Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;② 2HClO![]() 2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;2HClO
2HCl+O2↑,故答案为:Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO;2HClO![]() 2HCl+O2↑。
2HCl+O2↑。

【题目】焦炭是重要的工业原材料。
(1)已知在一定温度下,C(s)+CO2(g) ![]() 2CO(g) 平衡常数K1;C(s)+H2O(g)
2CO(g) 平衡常数K1;C(s)+H2O(g) ![]() CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g)
CO(g)+H2(g) 平衡常数K2 ;CO(g)+H2O(g) ![]() H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
H2(g)+CO2(g) 平衡常数K。则K、K1、K2,之间的关系是__________。
(2)用焦炭还原NO的反应为:2NO(g)+ C(s)![]() N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g) + CO2(g) ΔH,向容积均为1L的甲、乙、丙三个恒温(反应温度分别为400℃、T ℃、400℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 40 | 80 | 120 | 160 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
n(NO)(丙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
①甲容器中,0~40 min内用NO的浓度变化表示的平均反应速率v(NO)=_____________ ;
②该反应的平衡常数表达式为__________________;400℃,该反应的平衡常数为_______;
③乙容器的反应温度T____400 ℃(填“>”“<”或“=”)
④丙容器达到平衡时,NO的转化率为___________;平衡时CO2的浓度为________。
⑤在恒容密闭容器中加入焦炭并充入NO气体,下列图像正确且能说明反应达到平衡状态的是___。