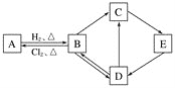
题目内容
【题目】按要求填空。
(1)过氧化钠与CO2反应的化学方程式:__;
(2)铁与水蒸气反应的化学方程式:__。
(3)实验室配制FeSO4溶液,溶解时先要加入少量的稀硫酸,配制完毕后要加入少量铁屑,其目的是___,向FeSO4溶液中滴加NaOH溶液,并放置一段时间,此过程中观察到的现象__。
【答案】2Na2O2+2CO2 = 2Na2CO3+O2 3Fe+4H2O(g)![]() Fe3O4+4H2 防止Fe2+被氧化 白色沉淀生成,且白色沉淀迅速变成灰绿色,最后变成红褐色
Fe3O4+4H2 防止Fe2+被氧化 白色沉淀生成,且白色沉淀迅速变成灰绿色,最后变成红褐色
【解析】
(3)硫酸亚铁溶液中,亚铁离子在溶液中发生水解生成氢氧化亚铁和氢离子,为了抑制亚铁离子水解,通常加入少量的稀硫酸;亚铁离子容易被氧化成铁离子,为了防止亚铁离子被氧化,配制完毕后需要加入少量铁屑,向FeSO4溶液中滴加NaOH溶液反应生成白色氢氧化亚铁沉淀,氢氧化亚铁不稳定易被空气中的氧气氧化生成红褐色氢氧化铁沉淀。
(1)过氧化钠与CO2反应的化学方程式:2Na2O2+2CO2 = 2Na2CO3+O2,
故答案为:2Na2O2+2CO2 = 2Na2CO3+O2;
(2)铁与水蒸气反应的化学方程式:3Fe+4H2O(g)![]() Fe3O4+4H2,
Fe3O4+4H2,
故答案为:3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(3)实验室配制的FeSO4溶液中,由于亚铁离子部分水解生成氢氧化亚铁,反应的离子方程式为:Fe2++2H2OFe(OH)2+2H+,为了制Fe2+的水解,通常加入稀硫酸,使氢离子浓度增大,水解平衡向左移动,即抑制Fe2+水解;由于Fe2+极易被O2氧化而变为黄色的Fe3+溶液,所以配制完毕后要加入少量铁屑,防止Fe2+被空气中的氧气氧化成Fe3+,向FeSO4溶液中滴加NaOH溶液反应生成白色氢氧化亚铁沉淀,放置一段时间,氢氧化亚铁不稳定易被空气中的氧气氧化生成红褐色氢氧化铁沉淀,并此过程中观察到的现象白色沉淀生成,且白色沉淀迅速变成灰绿色,最后变成红褐色,
故答案为:防止Fe2+被氧化;白色沉淀生成,且白色沉淀迅速变成灰绿色,最后变成红褐色。

【题目】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3 , 还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
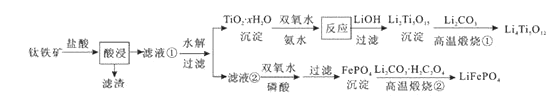
下列说法不正确的是( )
A.“酸浸”后,若钛主要以TiOCl42-形式存在,则相应反应的离子方程式可表示为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
B.若Li2Ti5O15中Ti的化合价为+4,则其中过氧键的数目为3个
C.“高温煅烧②”中由FePO4制备LiFePO4的化学方程式可表示为:2FePO4+Li2CO3+H2C2O4![]() 2LiFePO4+H2O↑+3CO2↑
2LiFePO4+H2O↑+3CO2↑
D.TiO2 · xH2O沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度/ ℃ | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | 88 |
可知,40 oC前,未达到平衡状态,随着温度升高,转化率变大;40 oC后,H2O2分解加剧,转化率降低
【题目】汽车尾气中含有CO、NO、NO2、碳氢化合物等多种污染物。回答下列问题:
(1)已知:2C8H18(1)+25O2(g)=16CO2(g)+18H2O(g) △H1=-10244kJ·mol-1
N2(g)+O2(g)=2NO(g) △H2
2NO(g)+2CO(g)=N2(g)+2CO2(g) △H3=-746kJ·mol-1
①若H2O(1)=H2O(g) △H=+44kJ·mol-1,则表示辛烷燃烧热的热化学方程式为______________________________________________。
②部分化学键键能数据如下:
化学键 | O=O | C=O | C≡O |
E/(kJ·mol) | 494 | 799 | 1076 |
△H2=__________kJ·mol-1
(2)1573K时,N2+O2![]() 2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
2NO平衡常数为2. 0×10-6,若测得内燃机内平衡混合气中氮气、氧气的物质的量分别为0. 2mol、0. 001mol,则生成NO的物质的量为__________mol,N2的转化率为__________。
(3)反应NO(g)+CO(g)=N2(g)+CO2(g)的平衡常数为1. 68×1060,从热力学角度看,该反应程度应该很大,实际汽车尾气中该反应的程度很小,原因是________________,要增大汽车尾气净化装置中单位时间内该反应的程度,关键是要_____________。
(4)T<500K时,反应NO2(g)+CO(g)=NO(g)+CO2(g)分两步进行:
第一步:NO2(g)+NO2(g)→NO3(g)+NO(g) (慢反应)
第二步:NO3(g)+CO(g)→NO(g)+CO2(g) (快反应)
下列表述正确的是__________(填标号)
A. 反应速率与NO浓度有关 B. 反应速率与NO2浓度有关
C. 反应的中间产物只有NO3 D. 第二步反应活化能较高
【题目】根据实验操作和现象所得出的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向盛有KI3溶液的试管中加入适量CCl4,振荡后静置,CCl4层显紫色(已知I3- | KI3在CCl4中的溶解度比在水中的大 |
B | 向淀粉溶液中加入稀硫酸水浴加热后,再加入银氨溶液水浴加热,未出现银镜 | 淀粉未发生水解 |
C | 向饱和Na2CO3溶液中加入少量BaSO4粉末搅拌,过滤,向洗净的沉淀中加入稀盐酸,有气体放出 | Ksp(BaSO4)>Ksp(BaCO3) |
D | 向新制饱和氯水中滴加紫色石蕊试液,溶液先变红后褪色 | 氯水具有酸性和漂白性 |
A.AB.BC.CD.D