题目内容
【题目】氧化镁是优良的阻燃剂,同时在医药、建筑等行业的应用也十分广泛。用硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量SiO2、FeCO3等)为原料制备高纯氧化镁的实验流程如下:

已知在水溶液中生成氢氧化物沉淀的pH:
Mg(OH)2 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 9.4 | 7.6 | 1.5 |
完全沉淀时 | 10.4 | 9.7 | 2.8 |
(1)菱镁矿酸溶前需要粉碎,目的是_______________。
(2)加入H2O2氧化时,发生反应的离子方程式为______________________。
(3)加氨水调节溶液的pH范围为________ ,滤渣2 的主要成分是____________(填化学式)。
(4)流程图中在获得滤渣2的“过滤”与“煅烧”之间要经过的操作步骤为_______、过滤等操作,得到MgSO4·xH2O晶体。
(5)已知煅烧12.3gMgSO4·xH2O晶体得到2gMgO,则x值为_____________。
【答案】提高酸溶速率 2Fe2++H2O2 + 2H+=2Fe3++ 2H2O 2.8<pH<9.4 Fe(OH)3 蒸发浓缩、冷却结晶 7
【解析】
菱镁矿(主要成分为MgCO3,含少量SiO2、FeCO3等)加入硫酸,碳酸镁和碳酸亚铁溶解生成对应的镁离子和亚铁离子,二氧化硅不溶于硫酸,过滤得到滤渣1为二氧化硅。滤液中加入过氧化氢,氧化亚铁离子生成铁离子,再加入氨水调节溶液的pH,生成氢氧化铁沉淀,过滤得滤渣2为氢氧化铁,滤液经过一系列过程最后煅烧生成氧化镁。
(1)菱镁矿粉碎是为了增大接触面积,提高酸溶速率。
(2)亚铁离子被过氧化氢氧化,离子方程式为:2Fe2++H2O2 + 2H+=2Fe3++ 2H2O;
(3)调节溶液的pH,使铁离子沉淀,但镁离子不能沉淀,根据表格数据分析,pH范围为2.8<pH<9.4,滤渣2的主要成分为 Fe(OH)3。
(4)要得到硫酸镁晶体,需要将滤液进行蒸发浓缩、冷却结晶,过滤,洗涤,干燥得到硫酸镁晶体。
(5) MgSO4·xH2O----MgO
120+18x 40
12.3 2
则有![]() ,计算x=7。
,计算x=7。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】已知化学反应①:Fe(s)+CO2(g)![]() FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其化学平衡常数为K1;化学反应②:Fe(s)+H2O(g)![]() FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
FeO(s)+H2(g),其化学平衡常数为K2,在温度973 K和1173 K的情况下,K1、K2的值分别如下:
温度 | K1 | K2 |
973 K | 1.47 | 2.38 |
1 173 K | 2.15 | 1.67 |
(1)通过表格中的数值可以推断:反应①是_______(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g)![]() CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的表达式:K3=______。
(3)根据反应①与②可推导出K1、K2与K3之间的关系式为__________,据此关系式及上表数据,能推断出反应③是________(填“吸热”或“放热”)反应。
(4)要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施有______ 、_____ (填写字母序号)。
A.缩小反应容器的容积 B.扩大反应容器的容积
C.升高温度 D.使用合适的催化剂
E.设法减小平衡体系中的CO的浓度
(5)图甲、乙分别表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
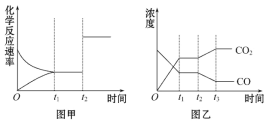
①图甲中t2时刻发生改变的条件是__________。
②图乙中t2时刻发生改变的条件是__________。

