题目内容
【题目】
(一) 现代铝的精炼研究方向是减低能耗。如图 :室温下通过电解在阴极沉积纯铝,A1Br3 在苯(简写 ArH)中可以生成[A12Br5ArH]+和 Br-。

(1)阳极的材料________;
(2)写出阴极沉积铝的电极方程式__________________________________________;
(二)邻硝基苯甲酸是重要的医院中间体,最新合成方法是邻硝基甲苯和高锰酸钾在相转移催化剂季铵盐(Q+X-)氧化、酸化合成,其原理如下:

相转移催化原理如下:

有关物质的物理性质如下表:
物质 | 邻硝基苯甲酸 | 高锰酸钾 | 苄基三乙基氯化铵(C6H5-CH2CH2)N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵(C4H9)4NBr | NH4Cl |
水 | 难溶 | 易溶 | 可溶 | 任意比互溶溶 | 可溶 | 易溶 |
有机物 | 易溶 | 难溶 | 易溶 | 易溶 | 易溶 | 难溶 |
下列说法不合理的是________;
A.相转移催化剂作用主要决定于 Q+的物理化学性质
B.反应中为了防止温度剧烈升高,投料应该分批加入
C.Q+X-是通过增大反应接触面积提高反应速率
D.增大压强可以提高邻硝基甲苯氧化的反应限度
E.工业使用季铵盐(Q+X-)可以提高邻硝基苯甲酸产率
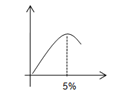
(2)四丁基溴化铵(C4H9)4NBr 萃取水中的高锰酸钾的方程式为:KMnO4(aq) +Q+X-(aq) →Q+ MnO4- (aq) +KX(aq),写出平衡常数 k 的表达式________________;设n(Q+X-):n(邻硝基甲苯)=x,理论证明当 x=5%邻硝基甲酸产率 y 得到最大值,请画出 y 随 x 变化的示意图________________ 。
(3)实验表明,当温度 100℃、反应时间 2.5h,n(KMnO4): n(邻硝基甲苯)=3:1,催化剂用量相同,Q+X-反应的催化效果如下:
相转移催化剂 | 苄基三乙基氯化铵 (C6H5-CH2CH2) N(C2H5)3Cl | 聚乙二醇 | 四丁基溴化铵 (C4H9)4NBr |
产率% | 46.7 | 20.0 | 53.1 |
苄基三乙基氯化铵比四丁基溴化铵催化效果差的原因_____________________________;工业生产不用聚乙二醇做催化剂的主要原因____________________________________ ;
(4)(C4H9)4NBr 为催化剂,邻硝基甲苯和高锰酸钾反应,测得溶液酸碱性对产率、反应时间影响如图 ,下列推测合理的是________。

A.溶液碱性强产率降低是因为季铵盐发生水解反应
B.pH=2 高锰酸钾一定发生副反应
C.选择 pH=7、适当升温可以提高产率
D.工业可以选择浓硝酸替代高锰酸钾做氧化剂,减缓对设备的腐蚀
【答案】粗铝 [Al2Br5ArH]++6e-→2Al+5Br-+ArH C D ![]()
 苄基比烷基带负电多,与MnO4-相排斥,不利于携带KMnO4进入有机体 聚乙二醇再水中溶解度大,反应过程损失多,造成MnO4-减少 B C
苄基比烷基带负电多,与MnO4-相排斥,不利于携带KMnO4进入有机体 聚乙二醇再水中溶解度大,反应过程损失多,造成MnO4-减少 B C
【解析】
(一) (1)因室温下通过电解在阴极沉积纯铝,A1Br3 在苯(简写 ArH)中可以生成[A12Br5ArH]+和 Br-,阳极粗铝失电子发生氧化反应,故阳极的材料为粗铝;
(2)阴极[Al2Br5ArH]+得电子产生铝单质,沉积铝的电极方程式为[Al2Br5ArH]++6e-→2Al+5Br-+ArH;
(二) (1)A.相转移催化剂作用主要决定于Q+与的的溶解性及反应难易程度,故与物理化学性质有关,选项A合理;
B.反应中为了防止温度剧烈升高,投料应该分批加入,以免温度急剧上升,选项B合理;
C.Q+X-是通过改变酸碱性提高反应速率,选项C不合理;
D.反应在溶液中进行,压强对反应的影响较小,故增大压强不能提高邻硝基甲苯氧化的反应限度,选项D不合理;
E.工业使用季铵盐(Q+X-)可以提高邻硝基苯甲酸产率,选项E合理;
答案选CD;
(2)四丁基溴化铵(C4H9)4NBr 萃取水中的高锰酸钾的方程式为:KMnO4(aq) +Q+X-(aq) →Q+ MnO4- (aq) +KX(aq),平衡常数 k 的表达式为![]() ;设n(Q+X-):n(邻硝基甲苯)=x,理论证明当 x=5%邻硝基甲酸产率 y 得到最大值, 则曲线先升高后降低,y 随 x 变化的示意图如下
;设n(Q+X-):n(邻硝基甲苯)=x,理论证明当 x=5%邻硝基甲酸产率 y 得到最大值, 则曲线先升高后降低,y 随 x 变化的示意图如下 ;
;
(3)根据表中信息可知,
苄基三乙基氯化铵比四丁基溴化铵催化效果差的原因苄基比烷基带负电多,与MnO4-相排斥,不利于携带KMnO4进入有机体;工业生产不用聚乙二醇做催化剂的主要原因聚乙二醇再水中溶解度大,反应过程损失多,造成MnO4-减少;
(4)A.溶液碱性强产率降低是因为季铵盐电离程度增大,选项A错误;
B.pH=2 高锰酸钾一定发生副反应,氧化性较强,发生氧化还原反应,选项B正确;
C.选择 pH=7、适当升温,则减少高锰酸钾的损失及温度升高反应速率增大且平衡向正反应方向移动,则可以提高产率,选项C正确;
D.工业可以选择浓硝酸替代高锰酸钾做氧化剂,会引入新的杂质,选项D错误。
答案选BC。

【题目】某小组同学探究物质的溶解度大小与沉淀转化方向之间的关系。已知:
物质 | BaSO4 | BaCO3 | AgI | AgCl | |
溶解度/g(20℃) | 2.4×10-4 | 1.4×10-3 | 3.0×10-7 | 1.5×10-4 |
(1)探究BaCO3和BaSO4之间的转化
实验操作:
试剂A | 试剂B | 试剂C | 加入盐酸后的现象 | |
实验Ⅰ | BaCl2 | Na2CO3 | Na2SO4 | …… |
实验Ⅱ | Na2SO4 | Na2CO3 | 有少量气泡产生,沉淀部分溶解 |
① 实验Ⅰ说明BaCO3全部转化为BaSO4,依据的现象是加入盐酸后,______。
② 实验Ⅱ中加入稀盐酸后发生反应的离子方程式是______。
③ 实验Ⅱ说明沉淀发生了部分转化,结合BaSO4的沉淀溶解平衡解释原因:______。
(2)探究AgCl和AgI之间的转化
实验Ⅲ:
实验Ⅳ:在试管中进行溶液间反应时,同学们无法观察到AgI转化为AgCl,于是又设计了如下实验(电压表读数:a>c>b>0)。
装置 | 步骤 | 电压表读数 | |
| ⅰ.如图连接装置并加入试剂,闭合K | a | |
ⅱ.向B中滴入AgNO3(aq),至沉淀完全 | b | ||
ⅲ.再向B中投入一定量NaCl (s) | c | ||
ⅳ.重复ⅰ,再向B中加入与ⅲ等量NaCl(s) | a |
注:其他条件不变时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大;离子的氧化性(或还原性)强弱与其浓度有关。
① 实验Ⅲ证明了AgCl转化为AgI,甲溶液可以是______(填序号)。
a. AgNO3溶液 b. NaCl溶液 c. KI溶液
② 实验Ⅳ的步骤ⅰ中,B中石墨上的电极反应式是______。
③ 结合信息,解释实验Ⅳ中b<a的原因:______。
④ 实验Ⅳ的现象能说明AgI转化为AgCl,理由是______。
(3)综合实验Ⅰ~Ⅳ,可得出结论: ______。