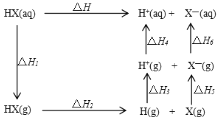
题目内容
【题目】常温下,Ka (HCOOH)=1.77×10-4,Ka (CH3COOH)=1.75×10-5,Kb (NH3·H2O) =1.76×10-5,下列说法正确的是( )
A. 将CH3COONa溶液从20℃升温至30℃,溶液中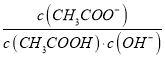 增大
增大
B. 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C. 0.2 mol/L HCOOH 与 0.1 mol/L NaOH 等体积混合后:c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D. 0.2 mol/L CH3COONa 与 0.1 mol/L盐酸等体积混合后 (pH<7):c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+)
【答案】D
【解析】CH3COONa的水解过程为吸热,所以升高温度,平衡右移,水解平衡常数c(OH-) ×c(CH3COOH) /c(CH3COO-)增大,溶液中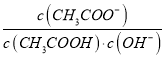 减小,A错误;pH相同的HCOOH和
减小,A错误;pH相同的HCOOH和![]() ,浓度:
,浓度:![]() ,用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和
,用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和![]() 溶液至终点时,酸的浓度越大,消耗的碱体积越大,pH、体积相同的HCOOH和
溶液至终点时,酸的浓度越大,消耗的碱体积越大,pH、体积相同的HCOOH和![]() ,物质的量前者小于后者,所以后者消耗的NaOH体积多,B错误;两溶液等体积混合后得到甲酸和甲酸钠溶液,由电荷守恒c(H+)+c(Na+)=c(OH-)+c(HCOO-)和物料守恒2c(Na+)=c(HCOOH)+c(HCOO-)可得c(HCOO-) + 2c(OH-) = c(HCOOH) + 2c(H+),C项错误;二者混合后溶液中的溶质为等物质的量浓度的
,物质的量前者小于后者,所以后者消耗的NaOH体积多,B错误;两溶液等体积混合后得到甲酸和甲酸钠溶液,由电荷守恒c(H+)+c(Na+)=c(OH-)+c(HCOO-)和物料守恒2c(Na+)=c(HCOOH)+c(HCOO-)可得c(HCOO-) + 2c(OH-) = c(HCOOH) + 2c(H+),C项错误;二者混合后溶液中的溶质为等物质的量浓度的![]() 、
、![]() 和NaCl,混合溶液的
和NaCl,混合溶液的![]() ,说明醋酸电离程度大于醋酸钠水解程度,乙酸是弱酸,其电离程度较小,所以粒子浓度大小顺序是c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+);D正确;正确选项D。
,说明醋酸电离程度大于醋酸钠水解程度,乙酸是弱酸,其电离程度较小,所以粒子浓度大小顺序是c(CH3COO-) > c(Cl- ) >c(CH3COOH) >c(H+);D正确;正确选项D。

 期末集结号系列答案
期末集结号系列答案【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D