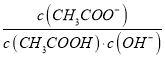题目内容
【题目】实验室里用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)来制备绿矾(FeSO4·7H2O)和聚铁(碱式硫酸铁的聚合物),其过程如下:

(1)若用浓硫酸配制过程①所需的250mL3.0mol·L-1的稀硫酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要_____。
(2)过程②用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有_____(填仪器名称),该过程产生的尾气会对大气造成污染,可选用下列试剂中的_____吸收。
a.浓硫酸 b.蒸馏水 c.NaOH溶液 d.浓硝酸
(3)过程③中,需要加入的物质名称是____,检验溶液X中金属阳离子是否完全转化的试剂为_____(填试剂名称)。
(4)过程④的操作是将溶液______、_____、过滤、洗涤,即得到FeSO4·7H2O晶体。过程⑥中,将溶液Z加热到70~80℃,目的是__。
(5)实验室为测定所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取样品2.700g;②将样品溶于足量盐酸后,加入足量的氯化钡溶液;③过滤、洗涤、干燥、称量,得固体质量为3.495g。若该聚铁主要成分为[Fe(OH)SO4]n,则该聚铁中铁元素的质量分数为____。
【答案】250mL容量瓶、胶头滴管 坩埚 c 铁 硫氰化钾溶液 蒸发(浓缩) (冷却)结晶 促进Fe3+的水解 31.11%
【解析】
烧渣中加入稀硫酸、同时通入氧气,过滤后,得到固体W中含有S、SiO2,再灼烧后尾气中含有二氧化硫,溶液X含有硫酸铁及未反应的硫酸,溶液X中加入Fe粉,反应完毕,过滤得到溶液Y为FeSO4溶液,再经过蒸发浓缩、冷却结晶、过滤、洗涤等得到绿矾。溶液X调节pH得到溶液Z,加热促进Fe3+的水解得到聚铁胶体,再经过胶体聚沉得到聚铁,以此解答该题。
(1)用浓硫酸配制250 mL 3.0 mol·L-1的稀硫酸,应用250 mL的容量瓶,最后定容时需用胶头滴管;故答案为:250mL容量瓶、胶头滴管;
(2)实验室中灼烧固体可以在坩埚中进行;固体W燃烧生成的污染物是SO2,用碱液吸收;故答案为:坩埚;c;
(3)从流程图可知,溶液X中的铁元素以Fe3+存在,绿矾中的铁元素为Fe2+形式,故应加入铁粉,将Fe3+还原为Fe2+,检验溶液中是否还含有Fe3+的试剂是硫氰化钾溶液;故答案为:铁;硫氰化钾溶液;
(4)将溶液Y蒸发浓缩,得到高浓度的FeSO4溶液,然后经冷却结晶即可得到FeSO4·7H2O晶体。升高温度促进Fe3+的水解,若温度过低,Fe3+水解程度低不利于聚铁的生成,若温度太高,Fe3+完全水解则不利于聚铁的形成;故答案为:蒸发(浓缩);(冷却)结晶;促进Fe3+的水解;
(5)③得到的沉淀是BaSO4,n(BaSO4)=3.495g÷233g/mol=0.015mol,根据聚铁主要成分为[Fe(OH)SO4]n,推出n(Fe3+)=0.015mol,则m(Fe3+)=0.84 g,铁元素的质量分数:w(Fe)=(0.84 g/2.700 g)×100%=31.11%,故答案为:31.11%。

【题目】某实验小组做乙醛和新制氢氧化铜的反应时,发现NaOH的用量对反应产物有影响,于是他们采用控制变量的方法,均使用0.5 mL 40%的乙醛溶液进行下列实验。
乙醛溶液进行下列实验.
编号 | 2%CuSO4溶液的体积 | 10%NaOH溶液的体积 | 振荡后 | pH | 加乙醛水浴加热后的沉淀颜色 |
1 | 2mL | 3滴 | 浅蓝绿色沉淀 | 5~6 | 浅蓝绿色沉淀 |
2 | a | 15滴 | 浅蓝色沉淀 | 7~8 | 黑色沉淀 |
3 | 1mL | 1mL | 蓝色悬浊沉淀较少 | 9~10 | 红褐色沉淀 |
4 | b | 2mL | 蓝色悬浊沉淀较多 | 11~12 | 红色沉淀 |
5 | 1mL | 3mL | 蓝紫色溶液 | 12~13 | ---- |
(1)上表中a、b应为(填字母序号)。___________________
A.15滴,1 mL B.2 mL,1 mL C.15滴,2 mL D.2 mL,2 mL
(2)查阅资料可知,实验1中的浅蓝绿色沉淀的主要成份为Cu2(OH)2SO4,受热不易分解。写出生成Cu
(3)小组同学推测实验3中的红褐色沉淀可能是CuO和Cu2O的混合物,其依据是___________。
(4)由实验4可以得出结论:当NaOH的用量较大时,新制氢氧化铜可以与乙醛发生反应,生成Cu2O红色沉淀。该反应的化学方程式为_________。
(5)为了进一步证明实验4中红色沉淀的成分,该小组同学查阅资料得知:Cu2O在碱性条件下稳定,在酸性溶液中可转化为Cu2+、Cu。并进行了以下实验。
ⅰ.将实验4反应后的试管静置,用胶头滴管吸出上层清液。
ⅱ.向下层浊液中加入过量稀硫酸,充分振荡、加热,应观察到的现象是_______________。
(6)小组同学继续查阅资料得知:Cu(OH)2可与OH-继续反应生成蓝紫色溶液([Cu(OH)4]2-),由此提出问题:[Cu(OH)4]2-能否与乙醛发生反应,生成红色沉淀?设计实验解决这一问题,合理的实验步骤是__________________基于上述实验,该小组同学获得结论:乙醛参与反应生成红色沉淀时,需控制体系的pH>10。
【题目】某同学用已知浓度的盐酸来测定某氢氧化钠样品的纯度(杂志不参与反应),试根据实验回答下列问题:
(1)准确称量5.0 g含有少量易溶杂质的样品,配成1L待测溶液。称量时,样品可放在________(填字母)称量。
A.小烧杯中 B.洁净纸片上 C.托盘上
(2)滴定时,用0.100 0 mol·L-1的盐酸来滴定待测溶液,可选用________作指示剂。
A.甲基橙 B.石蕊 C.酚酞
(3)滴定过程中氢氧化钠溶液放在锥形瓶中,则盐酸应该放在_______(填“甲”或“乙”)中。该同学选用酚酞做指示剂,如何判断达到滴定终点:_______________________________。

(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是______________ mol·L-1,烧碱样品的纯度是_______________。
滴定次数 | 待测溶液 体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 10.50 |
第二次 | 10.00 | 4.10 | 14.00 |
第三次 | 10.00 | 2.50 | 14.00 |
(5)下列实验操作会对滴定结果产生什么后果?(填“偏高”“偏低”或“无影响”)
①观察酸式滴定管液面时,开始平视,滴定终点俯视,则滴定结果______________。
②滴定前酸式滴定管尖嘴处有气泡,滴定后气泡消失,则滴定结果______________。
③洗涤后锥形瓶未干燥,则滴定结果______________。
【题目】下列实验操作及现象能够达到对应实验目的是( )
选项 | 实验操作及现象 | 实验目的 |
A | 向溶液中加入盐酸无现象,再加入氯化钡溶液产生白色沉淀 | 检验溶液中有 |
B | 常温下,向饱和 | 证明常温下, |
C | 常温下,测定盐酸和醋酸溶液的pH:盐酸pH小于醋酸pH | 证明相同条件下,在水中HCl电离程度大于 |
D | 将浓硫酸与碳混合加热,直接将生成的气体通入足量的澄清石灰水,石灰水变浑浊 | 检验气体产物中 |
A.AB.BC.CD.D