题目内容
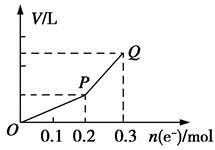
用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入

| A.0.1 mol CuO | B.0.1 mol CuCO3 |
| C.0.1 mol Cu(OH)2 | D.0.05 mol Cu2(OH)2CO3 |
D
观察图像中曲线的斜率可知,OP段和PQ段气体的成分不同。由于阳极始终是OH-放电,所以可以推断出,OP段只有阳极产生O2(阴极无气体生成),PQ段阴、阳两极都产生气体。因此,整个过程发生的反应为①2CuSO4+2H2O2Cu+2H2SO4+O2↑和②2H2OH2↑+O2↑。结合图像中转移电子的物质的量,可计算出反应①析出0.1 mol Cu和0.05 mol O2,反应②消耗0.05 mol H2O。根据“出什么加什么,出多少加多少”的原则,欲使溶液恢复到起始状态,应向溶液中加入0.1 mol CuO和0.05 mol H2O。而0.05 mol Cu2(OH)2CO3恰好相当于0.1 mol CuO和0.05 mol H2O(生成0.05 mol CO2无影响),故D正确。

练习册系列答案
相关题目
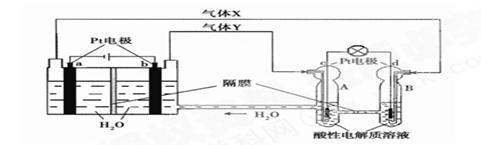

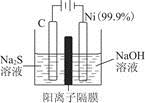
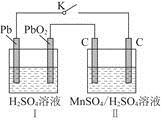
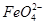 。实验过程中,两极均有气体产生,Y极区溶液逐渐生成
。实验过程中,两极均有气体产生,Y极区溶液逐渐生成