题目内容
将0.1 mol 铜与40 mL 10 mol·L-1HNO3充分反应后,溶液中含a mol H+,由此可知
| A.生成的气体在标准状况下的体积为4.48 L |
| B.生成的气体在标准状况下的体积为1.49 L |
| C.被还原的硝酸的物质的量为(0.2-a) mol |
| D.反应后溶液中所含NO3-的物质的量为0.2 mol |
C
分析:n(HNO3)=0.04L×10mol/L=0.4mol,铜和浓硝酸发生:Cu+4HNO3=Cu(NO3)2+2NO2↑+2H2O,与稀硝酸发生:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,充分反应后,溶液中含amolH+,则剩余硝酸amol,生成Cu(NO3)20.1mol,以此解答该题.
解:A.n(HNO3)=0.04L×10mol/L=0.4mol,生成0.1molCu(NO3)2,溶液中含amolH+,则剩余硝酸amol,根据N原子守恒,
可知生成气体的物质的量为0.4mol-0.2mol-amol=(0.2-a)mol,体积为22.4×(0.2-a)L,故A错误;
B.由A的分析可知,生成的气体在标准状况下的体积为22.4×(0.2-a)L,故B错误;
C.根据N原子守恒,可知生成气体的物质的量为0.4mol-0.2mol-amol=(0.2-a)mol,即被还原的硝酸的物质的量,故C正确;
D.反应后溶液中所含NO3-的物质的量为0.1molCu(NO3)2和剩余amol硝酸的NO3-物质的量之和,为(0.2+a)mol,故D错误.
故选C.

练习册系列答案
相关题目
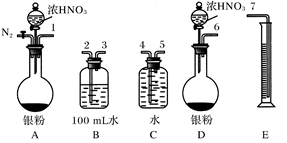
 NO。其实验流程图如下:
NO。其实验流程图如下:
 ②
②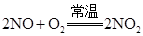

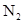 、NO、
、NO、 的还原性强弱顺序是
的还原性强弱顺序是 反应,则该硝酸的物质的量浓度为
反应,则该硝酸的物质的量浓度为