题目内容
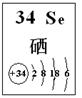
A、B、C为三种短周期元素,A、B在同周期, A、C的最低价离子分别为A2-和C-,B2+和C-具有相同的电子层结构。下列说法中正确的是 ( )
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
A.原子序数:A>B>C B.原子半径:A>B>C
C.离子半径:A2->C->B2+ D.原子核外最外层电子数:A>C>B
AC
试题分析:由离子带的电荷可知,A、C为非金属元素,B为金属元素,又阳离子B2+和阴离子C-具有相同的电子层结构,则C元素在B的上一周期,A、B在同一个周期,所以可推知原子序数A>B>C,A正确;据元素周期律电子层数越多半径越大,可得原子半径B>C>A,B错误;电子层数相同时核电荷数越大半径反而小,则离子半径A2->C->B2+ ,C正确;原子核外电子数C>A>B,D错误;故选AC。

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案
相关题目
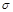 键与
键与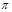 数目比为1:2
数目比为1:2 2EC3(g) △H<0,回答下列问题:
2EC3(g) △H<0,回答下列问题: