题目内容
【题目】为了测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A.冷却至室温后,在100 mL容量瓶中定容配成100 mL稀硫酸。
B.用某仪器量取20.00 mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C.将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用待测溶液润洗。
D.将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面记下开始读数为V1 mL。
E.小心滴入NaOH标准溶液,边滴边摇动锥形瓶,滴定至恰好反应为止,记下读数为V2 mL。
F.把锥形瓶移到碱式滴定管下,在锥形瓶下垫一张白纸。
G.用某仪器准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解。
就此实验操作完成下列填空:
(1)正确操作步骤的顺序(用编号字母填写)___→A→___→___→___→F→___。
(2)用来量取10.00 mL浓硫酸的仪器是___。用NaOH溶液润洗碱式滴定管的目的是___。
(3)滴定中可选用的指示剂是___。滴定中,目光应___;判断滴定终点的现象是___;读数时,目光与凹液面的最低处保持水平。
(4)某学生实验时用稀硫酸润洗了锥形瓶,测定的浓度会偏___。(“偏高”、“偏低”、“无影响”)。
(5)该浓硫酸样品的浓度计算式为______。
【答案】G C B D E 酸式滴定管 保证标准液浓度不被稀释 酚酞(或甲基橙) 注视锥形瓶中溶液颜色的变化 当滴加最后一滴NaOH溶液时,溶液的颜色由无色变为红色,且半分钟内不消失,证明达到滴定终点 偏高 0.25(V2-V1) mol/L
【解析】
(1)根据中和滴定原理和实验要求进行排序;
(2)准确量取10.00 mL浓硫酸,需要用精密量具,精确到0.1,估读到0.01,所以学过的量具中,滴定管、移液管是能精确计量的仪器,注意溶液的碱性;未用标准液润洗碱式滴定管,标准液碱的浓度偏小;判断滴定恰好完成的依据是红色突然出现且半分钟内不消失;
(3)根据强酸强碱盐呈中性,应选择酸性或碱性范围内变色的指示剂,如甲基橙或酚酞;根据滴定过程中,目光应注视锥形瓶中溶液颜色的变化,以便准确判断终点的到达;
(4)根据c(待测)=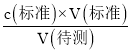 分析不当操作对V(标准)的影响,以此判断浓度的误差;
分析不当操作对V(标准)的影响,以此判断浓度的误差;
(5)硫酸与氢氧化钠反应的本质为:H++OH-=H2O,1 mol硫酸电离出2 mol氢离子,据此分析解答。
(1)用酸式滴定管准确量取浓硫酸样品10.00 mL,在烧杯中用蒸馏水溶解,冷却至室温后,在100 mL容量瓶中定容配成100 mL稀硫酸,用移液管移取20.00 mL稀硫酸于锥形瓶中并滴入几滴指示剂,将物质的量浓度为M mol/L的标准NaOH溶液装入碱式滴定管,调节液面,记下开始读数为V1,在锥形瓶下垫一张白纸,滴定至终点,记下读数V2,故正确的操作顺序为:G、A、C、B、D、F、E;
(2)酸式滴定管可以精确到0.01 mL,硫酸具有酸性,能用酸式滴定管来量取;若不用标准液润洗碱式滴定管,标准液碱的浓度偏小,所以NaOH溶液润洗碱式滴定管的目的是保证标准液浓度不被稀释;
(3)用一定物质的量浓度的NaOH标准溶液滴定未知浓度的H2SO4,硫酸和氢氧化钠反应生成硫酸钠,硫酸钠溶液呈中性,应选择酸性或碱性范围内变色的指示剂,可以用甲基橙或酚酞作指示剂;在滴定过程中,目光应注视锥形瓶中溶液颜色的变化。若使用酚酞为指示剂,开始溶液为无色,随着NaOH的滴入,溶液碱性逐渐增强,当滴加最后一滴NaOH溶液时,溶液的颜色由无色变为红色,且半分钟内不消失,证明达到滴定终点;
(4)实验时用稀硫酸润洗了锥形瓶,待测液的物质的量偏大,造成V(标准)偏高,根据c(待测)=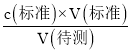 分析,可知c(待测)偏高;
分析,可知c(待测)偏高;
(5)浓硫酸样品10.00 mL,稀释为稀硫酸,配成100 mL稀硫酸,量取20.00 mL稀硫酸与M mol/L的标准NaOH作用,消耗氢氧化钠的体积为(V2 -V1 )mL,则消耗的n(NaOH)=c·V=M(V2-V1)×10-3 mol,硫酸与氢氧化钠反应的本质为:H++OH-=H2O,则n(H+)=c·V=M(V2-V1)×10-3 mol,1 mol硫酸电离出2 mol氢离子,n(H2SO4)=![]() n(H+)=
n(H+)=![]() M(V2-V1)×10-3 mol,浓硫酸样品10.00 mL,n(H2SO4)总=
M(V2-V1)×10-3 mol,浓硫酸样品10.00 mL,n(H2SO4)总=![]() n(H+)×
n(H+)×![]() =
=![]() M(V2-V1)×10-3 mol×
M(V2-V1)×10-3 mol×![]() =2.5M(V2-V1)×10-3 mol,所以该浓硫酸样品的浓硫酸计算式c=
=2.5M(V2-V1)×10-3 mol,所以该浓硫酸样品的浓硫酸计算式c=![]() =
=![]() mol/L=0.25(V2-V1) mol/L。
mol/L=0.25(V2-V1) mol/L。

 名校课堂系列答案
名校课堂系列答案