题目内容
下面是几种实验中常用的仪器:
A. B.
B. C.
C. D.
D.
(1)写出序号所代表的仪器的名称:B___________;C___________;D___________
实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)下列主要操作步骤的正确顺序是_______________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②“定容”
③待冷却至室温后,将溶液转移到500 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2—3次,洗涤液转移到容量瓶中。
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
(5)写出步骤②“定容”的具体操作:
(6)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。某学生课
外活动小组欲从海藻中提取碘,设计如下的流程:
(已知过程②中反应的离子方程式为:2I- + Cl2 = 2Cl- + I2)

Ⅰ.指出提取碘的过程中有关的实验操作的名称:① , ③ 。
Ⅱ.提取碘的过程中,可选择的有机溶剂是 (填序号) 。
A、酒精 B、醋酸 C 、四氯化碳
A.
 B.
B. C.
C. D.
D.
(1)写出序号所代表的仪器的名称:B___________;C___________;D___________
实验室要配制500 mL 0.2 mol/L NaOH溶液,请回答下列问题:
(2)用托盘天平称取氢氧化钠,其质量为_______________g。
(3)下列主要操作步骤的正确顺序是_______________(填序号)。
①称取一定质量的氢氧化钠,放入烧杯中,用适量蒸馏水溶解;
②“定容”
③待冷却至室温后,将溶液转移到500 mL 容量瓶中;
④盖好瓶塞,反复上下颠倒,摇匀;
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2—3次,洗涤液转移到容量瓶中。
(4)在配制过程中,其他操作都是正确的,下列操作会引起所配浓度偏高的是__________。
①没有洗涤烧杯和玻璃棒 ②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水 ④定容时俯视刻度线
⑤未冷却到室温就将溶液转移到容量瓶并定容
(5)写出步骤②“定容”的具体操作:
(6)海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。某学生课
外活动小组欲从海藻中提取碘,设计如下的流程:
(已知过程②中反应的离子方程式为:2I- + Cl2 = 2Cl- + I2)

Ⅰ.指出提取碘的过程中有关的实验操作的名称:① , ③ 。
Ⅱ.提取碘的过程中,可选择的有机溶剂是 (填序号) 。
A、酒精 B、醋酸 C 、四氯化碳
(1)B 1000ml容量瓶C 冷凝器D 分液漏斗(2)4.0 (3)①③⑤②④ (4)④⑤
(5)加水至液面离刻度线1—2cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。(6)Ⅰ过滤 萃取分液(或萃取)。Ⅱ.C。
(5)加水至液面离刻度线1—2cm时,改用胶头滴管滴加蒸馏水至凹液面最低处与刻度线相切。(6)Ⅰ过滤 萃取分液(或萃取)。Ⅱ.C。
试题分析:配制一定体积一定浓度的物质的量浓度的溶液步骤是:计算、称量、溶解、转移溶液、洗涤、定容、摇匀。所以主要操作步骤的正确顺序是①③⑤②④。由于C=n∕V=m∕MV.若分母偏小则浓度偏高。没有洗涤烧杯和玻璃棒使溶质质量偏少,浓度偏低;转移溶液时不慎有少量洒到容量瓶外面致使溶质质量偏少,浓度偏低;容量瓶不干燥,含有少量蒸馏水不会产生任何影响;定容时俯视刻度线使溶液的体积偏小,浓度偏高。NaOH溶解时放热,未冷却到室温就将溶液转移到容量瓶并定容,当恢复至室温时溶液的体积低于刻度线,即V偏小浓度偏高。萃取剂应该是与原来的溶剂互不相容且溶质在萃取剂中的要比在原来溶剂中要大,只有四氯化碳符合条件

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
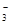 、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO
、SO42-、Fe3+、H+、M,其物质的量之比为:n(NO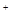 )︰n(M)=2︰3︰1︰3︰1,则M可能是下列中的
)︰n(M)=2︰3︰1︰3︰1,则M可能是下列中的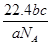 L
L