题目内容
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,甲、乙、丙为常见化合物。它们之间有如下转化关系:
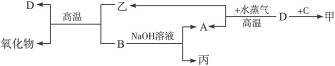
完成下列问题:
(1)A的电子式_____________。
(2)D与甲溶液反应的化学方程式:——————————。
(3)丙的水溶液显_____________(填“酸”或“碱”)性,原因是(用离子方程式表示)___________________________________________。
(4)一定条件下,2 mol B 与3 mol D 的氧化物W恰好反应,则W的化学式为________________________。
(1)H∶H (2)2FeCl3+Fe====3FeCl2 (3)碱 ![]() +2H2O
+2H2O![]() Al(OH)3+OH- (4)FeO
Al(OH)3+OH- (4)FeO
解析:
本题主要考查铝、铁的化学性质及学生的综合推断能力。B是能与NaOH溶液反应的单质,故B为Al或Si,根据B+乙![]() 氧化物+D,联想到Al能发生铝热反应,所以B为Al,然后依次推出A为H2,丙为NaAlO2。因为D+H2O(g)
氧化物+D,联想到Al能发生铝热反应,所以B为Al,然后依次推出A为H2,丙为NaAlO2。因为D+H2O(g)![]() H2+乙,而乙又能参与铝热反应,因此D为Fe,乙为Fe3O4,有关反应为:
H2+乙,而乙又能参与铝热反应,因此D为Fe,乙为Fe3O4,有关反应为:
3Fe+4H2O(g)![]() Fe3O4+4H2↑
Fe3O4+4H2↑
8Al+3Fe3O4![]() 4Al2O3+9Fe
4Al2O3+9Fe
据D+C![]() 甲,而D与甲溶液能反应,所以C为Cl2,甲为FeCl3,反应为2Fe+3Cl2
甲,而D与甲溶液能反应,所以C为Cl2,甲为FeCl3,反应为2Fe+3Cl2![]() 2FeCl3,2FeCl3+Fe====3FeCl2。
2FeCl3,2FeCl3+Fe====3FeCl2。
2 mol Al与3 mol W起反应,据铝、铁元素得失电子总数相等及原子守恒推知W为FeO,反应方程式为:
2Al+3FeO![]() Al2O3+3Fe
Al2O3+3Fe

练习册系列答案
相关题目
a、b、c、d是四种短周期元素.a、b、d同周期,c、d同主族.a的原子结构示意图为 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为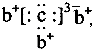 下列比较中正确的是( )
下列比较中正确的是( )
 ,b与c形成化合物的电子式为
,b与c形成化合物的电子式为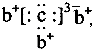 下列比较中正确的是( )
下列比较中正确的是( )| A、原子半径:a>c>d>b | B、最高价含氧酸的酸性c>d>a | C、原子序数:a>d>b>c | D、单质的氧化性a>b>d>c |
 ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2.回答下列问题:
 Al(OH)3+OH-
Al(OH)3+OH-