题目内容
某研究性学习小组用10g胆矾制取CuO,并证明CuO可以催化H2O2的分解反应。
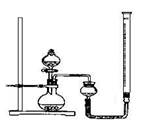
(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;
②向小烧杯中滴加NaOH溶液,至产生大量沉淀;
③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;
④将以上混合物过滤,洗涤,▲ ,然后研细;
⑤检查④中洗涤是否完全的操作是 ▲ 。
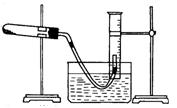
(2)用右图所示,按表中设计实验方法,证明CuO能催化
7%H2O2 溶液的分解,并与MnO2的催化效果进行比较。
① 从设计原理看,实验中的待测数据是 ▲ 。
② 为探究CuO在实验b中是否起催化作用,除与a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO ▲ 性质(选填“物理性质”或“化学性质”)在反应前后是否改变;
B. ▲ 。

(1)首先制备CuO,实验步骤如下,请完成缺少的步骤:
①称取10g胆矾,放入小烧杯中,再加水溶解;
②向小烧杯中滴加NaOH溶液,至产生大量沉淀;
③用酒精灯在石棉网上加热小烧杯,至沉淀物完全黑色;
④将以上混合物过滤,洗涤,▲ ,然后研细;
⑤检查④中洗涤是否完全的操作是 ▲ 。
(2)用右图所示,按表中设计实验方法,证明CuO能催化
7%H2O2 溶液的分解,并与MnO2的催化效果进行比较。
| 实验序号 | 双氧水体积 | 催化剂 | 待测数据 |
| a | 15mL | 无 | |
| b | 15mL | 0.5g CuO | |
| c | 15mL | 0.5g MnO2 | |
① 从设计原理看,实验中的待测数据是 ▲ 。
② 为探究CuO在实验b中是否起催化作用,除与a比较外,还应补充以下实验(不必写具体操作):
A.证明CuO ▲ 性质(选填“物理性质”或“化学性质”)在反应前后是否改变;
B. ▲ 。

略

练习册系列答案
相关题目
 假设三: ;
假设三: ;
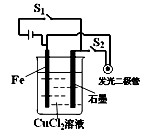
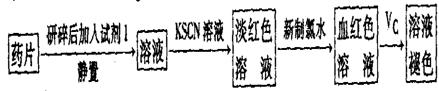
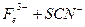
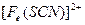 。
。 。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。
。准确称量上述药品10.00g,将其全部溶于试剂2中,配制成1000mL溶液,取出20.00mL,用0.0200mol/L的KMnO4溶液滴定,用去KMnO4溶液12.00mL。