题目内容
【题目】已知A、B、C、D、E是短周期的5种元素,它们的原子序数依次增大.A元素原子形成的离子核外电子数为零;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应;A与C同主族;B与E同主族;E的单质为黄色晶体,易溶于二硫化碳.
(1)请写出B、D元素的名称:B , D .
(2)画出C元素的离子结构示意图 .
(3)写出D的单质与C的最高价氧化物对应水化物之间反应的离子方程式 .
(4)A、B、C三种元素形成的化合物的电子式为 , 所含的化学键类型为 .
(5)A、E形成化合物的结构式为 .
【答案】
(1)氧;铝
(2)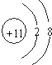
(3)Al+2OH﹣+2H2O═AlO2﹣+3H2↑
(4)![]() ;离子键、共价键
;离子键、共价键
(5)H﹣S﹣H
【解析】解:A元素原子形成的离子核外电子数为零,则A为H元素;A与C同主族,结合原子序数可知C为Na元素;E的单质为黄色晶体,易溶于二硫化碳,则E为S元素,B与E同主族,则B为O元素;C、D、E三种元素的最高价氧化物对应水化物之间可以两两反应,则D为Al元素.
(1.)由以上分析可知,B为O元素,D为Al元素,所以答案是:氧;铝;
(2.)C为Na元素,钠离子原子核内有11个质子,原子核外有10个电子,则钠离子结构示意图为: 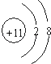 ,所以答案是:
,所以答案是: 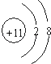 ;
;
(3.)D的单质为Al,C的最高价氧化物对应水合物为NaOH,铝与氢氧化钠溶液反应的离子方程式为:Al+2OH﹣+2H2O═AlO2﹣+3H2↑,所以答案是:Al+2OH﹣+2H2O═AlO2﹣+3H2↑;
(4.)A、B、C三种元素形成的化合物为NaOH,为离子化合物,其电子式为 ![]() ,NaOH中含有钠离子和氢氧根离子形成的离子键,其中OH﹣离子中O与H原子之间为共价键,所以氢氧化钠含有的化学键为离子键和共价键,所以答案是:
,NaOH中含有钠离子和氢氧根离子形成的离子键,其中OH﹣离子中O与H原子之间为共价键,所以氢氧化钠含有的化学键为离子键和共价键,所以答案是: ![]() ;离子键、共价键;
;离子键、共价键;
(5.)A、E形成化合物为硫化氢,硫化氢为共价化合物,其结构式为:H﹣S﹣H,所以答案是:H﹣S﹣H.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案