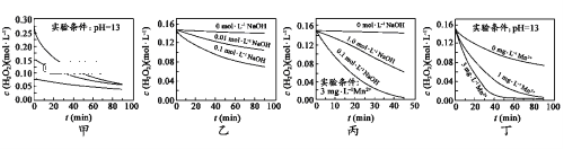
题目内容
【题目】(1)已知20.0g NaOH溶于水配成稀溶液与足量的盐酸反应,放出28.8kJ热量,那么此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水时,该反应放出热量______ kJ,由此测得的中和热为_____kJ/mol;
(2)已知断开1mol H—H键、1mol Br—Br键、1mol H—Br键分别需吸收的能量为436kJ、193kJ、366kJ。计算H2和Br2反应生成1mol HBr需 _______(填“吸收”或“放出”)能量_________ kJ;
(3)t℃时,将2mol SO2和1mol O2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g),2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
2SO3(g),2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,请填写下列空白:
①从反应开始到化学平衡,生成SO3的平均反应速率为____________________ ,平衡时SO2的转化率为__________;
②下列叙述能证明该反应已达到化学平衡状态的是__________(填标号)。
A. 容器内压强不再发生变化
B. SO2的体积分数不再发生变化
C. 容器内气体原子总数不再发生变化
D. 相同时间内消耗2n mol SO2的同时消耗n mol O2
E. 相同时间内消耗2n mol SO2的同时生成n mol O2
③t2℃时,若将物质的量之比n(SO2):n(O2) = 1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%。SO2的转化率为___________。
【答案】57.6 57.6 放出 51.5 0.1mol/(L·min) 20% ABE 80%
【解析】
(1)已知20.0g NaOH溶于水配成稀溶液与足量的盐酸反应,放出28.8kJ热量,20g氢氧化钠是0.5mol,生成0.5mol水,因此此反应数据表明:如果NaOH稀溶液跟稀盐酸中和生成18g水即1mol时,该反应放出热量57.6 kJ,由此测得的中和热为57.6 kJ/mol;
(2)已知断开1mol H—H键、1mol Br—Br键、1mol H—Br键分别需吸收的能量为436kJ、193kJ、366kJ,由于断键吸热,形成化学键放热,则生成2molHBr的焓变是436kJ/mol+193kJ/mol-2×366kJ/mol=-103kJ/mol,因此H2和Br2反应生成1mol HBr需放出能量51.5kJ;
(3)①2min时反应达到化学平衡,此时测得反应物O2还剩余0.8mol,因此消耗氧气是1mol-0.8mol=0.2mol,所以生成三氧化硫是0.4mol,浓度是0.2mol/L,则从反应开始到化学平衡,生成SO3的平均反应速率为0.2mol/L÷2min=0.1mol/(L·min),消耗二氧化硫是0.4mol,则平衡时SO2的转化率为0.4/2×100%=20%;
②A. 正反应体积减小,容器内压强不再发生变化说明反应达到平衡状态,A正确;
B. SO2的体积分数不再发生变化说明反应达到平衡状态,B正确;
C. 根据原子守恒可知容器内气体原子总数始终不变,不能据此说明反应达到平衡状态,C错误;
D. 相同时间内消耗2n mol SO2的同时消耗n mol O2均表示正反应速率,不能据此说明反应达到平衡状态,D错误;
E. 相同时间内消耗2n mol SO2的同时生成n mol O2说明正逆反应速率相等,反应达到平衡状态,E正确;
答案选ABE;
③ 2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始量(mol) 1 1 0
转化量(mol) x x/2 x
平衡量(mol)1-x 1-x/2 x
反应达到平衡时,混合气体体积减少了20%,则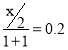 ,解得x=0.8,所以SO2的转化率为80%。
,解得x=0.8,所以SO2的转化率为80%。

【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
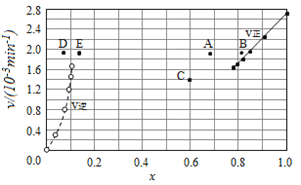
A. A D B. B D C. B E D. A E
【题目】氮的氧化物是大气污染物之一,用活性炭或一氧化碳还原氮氧化物,可防止空气污染。回答下列问题:
已知:2C(s)+O2(g)=2CO(g) ΔH=- 221 kJ/mol
C(s)+O2(g)=CO2(g) △H=- 393.5 kJ/mol
N2(g)+O2(g)=2NO(g) ΔH= +181 kJ/mol
(1)若某反应的平衡常数表达式为K=![]() ,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
,请写出此反应的热化学方程式:___________________________;下列措施能够增大此反应中NO的转化率的是(填字母代号)_________。
a.增大容器压强 b.升高温度 c.使用优质催化剂 d.增大CO的浓度
(2)向容积为2L的密闭容器中加入活性炭(足量)和NO,发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
N2(g)+CO2(g),NO和N2的物质的量变化如下表所示。
物质的量/mol | T1/℃ | T2/℃ | |||||
0 | 5 min | 10 min | 15 min | 20 min | 15 min | 30 min | |
NO | 2.0 | 1.16 | 0.80 | 0.80 | 0.50 | 0.40 | 0.40 |
N2 | 0 | 0.42 | 0.60 | 0.60 | 0.75 | 0.80 | 0.80 |
①0~5min内,以CO2表示的该反应速率v(CO2)=_____,该条件下的平衡常数K=__________。
②第15 min后,温度调整到T2,数据变化如上表所示,则T1_______ T2(填“>”、“<”或“=”)。
③若30min时,保持T2不变,向该容器中再加入该四种反应混合物各2 mol,则此时反应_______移动(填“正向”、“逆向”或“不”);最终达平衡时NO的转化率a=______________。
【题目】下列实验事实与相应结论不正确的是
选项 | 实验事实 | 结论 |
A | 其他条件不变,0.01 mol·L-1的酸性KMnO4溶液分别与0.1 mol·L-1的H2C2O4溶液和0.2 mol·L-1的H2C2O4溶液反应,后者褪色时间短 | 当其他条件不变时,增大反应物浓度可以使化学反应速率加快 |
B | 其他条件不变,分别将等体积、等物质的量浓度的Na2S2O3溶液和H2SO4混合液放在冷水和热水中,放在热水中的混合液先出现浑浊 | 当其他条件不变时,反应体系的温度越高,化学反应速率越快 |
C | 将少量MnO2粉末加入盛有10%双氧水的锥形瓶内,在化学反应前后,MnO2的质量和化学性质都没有发生改变 | 催化剂虽然可以加快化学反应的速率,但一定不参与化学反应过程 |
D | 一定条件下,分别在容积为1 L和容积为2 L的两个密闭容器中加入等量的氢气和碘蒸气,发生如下反应:H2(g)+I2(g) | 当其他条件不变时,气态反应体系的压强越大,化学反应速率越快 |
A. A B. B C. C D. D