题目内容
 [化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.
[化学一-选修物质结构与性质]周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,已知A原子2P轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+离子核外各亚层电子均已充满.根据以上信息回答下列问题:
(1)写出D原子核外电子排布式
(2)A、B、C、D的第一电离能由小到大的顺序为
(3)B的氯化物的熔点比D的氯化物熔点
(4)E的最高价氧化物分子的空间构型是
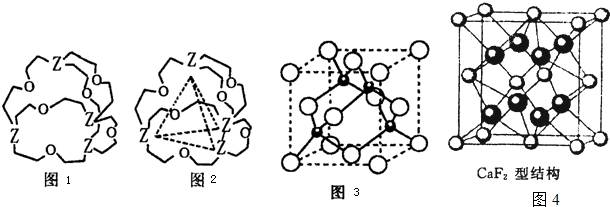
(5)E、F形成的某种化合物有如图所示的晶体结构:该化合物化学式为
分析:周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,A原子2P轨道有3个未成对电子,A原子核外电子排布式为1s22s22p3,则A是N元素;C元素是地壳中含量最高的金属元素,则C是Al元素;E原子核外的M层中只有两对成对电子,E原子核外电子排布式为1s22s22p63s23p4,E是S元素;化合物B2E的晶体为离子晶体,B显+1价为第IA族元素,B的原子序数大于N元素、小于Al元素,所以B是Na元素;结合原子序数可知D处于第三周期,D单质的晶体熔点在同周期形成的单质中是最高的,单质为原子晶体,所以D是Si元素;F2+离子核外各亚层电子均已充满,F原子序数大于S元素,则处于第四周期,F2+离子核外电子排布式为1s22s22p63s23p63d10,故F原子核外电子数为30,则F是Zn元素,据此解答.
解答:解:周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,A原子2P轨道有3个未成对电子,A原子核外电子排布式为1s22s22p3,则A是N元素;C元素是地壳中含量最高的金属元素,则C是Al元素;E原子核外的M层中只有两对成对电子,E原子核外电子排布式为1s22s22p63s23p4,E是S元素;化合物B2E的晶体为离子晶体,B显+1价为第IA族元素,B的原子序数大于N元素、小于Al元素,所以B是Na元素;结合原子序数可知D处于第三周期,D单质的晶体熔点在同周期形成的单质中是最高的,单质为原子晶体,所以D是Si元素;F2+离子核外各亚层电子均已充满,F原子序数大于S元素,则处于第四周期,F2+离子核外电子排布式为1s22s22p63s23p63d10,故F原子核外电子数为30,则F是Zn元素,
(1)D是Si元素,硅原子核外有14个电子,根据构造原理知,其基态原子核外电子排布式为:1S22S22P63S23P2,
故答案为:1S22S22P63S23P2;
(2)A、B、C、D分别是N、Na、Al、Si元素,同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na<Al<Si<P,P<N,
所以这几种元素的第一电离能大小顺序是:Na<Al<Si<N,
故答案为:Na<Al<Si<N;
(3)B的氯化物是NaCl,D的氯化物是SiCl4,氯化钠是离子晶体,四氯化硅是分子晶体,离子晶体的熔点大于分子晶体,故答案为:高;NaCl是离子晶体,SiCl4是分子晶体;
(4)E是S元素,SO3分子S原子含有3个σ键且不含孤电子对,所以为平面正三角形结构,三氧化硫分子中正负电荷重心重合,为非极性分子,故答案为:平面正三角形; 非极性;
(5)①E是S元素,F是Zn元素,S原子个数=8×
+6×
=4,Zn原子个数=4,所以该晶胞中S、Zn原子个数之比=4:4=1:1,所以其化学式为ZnS,故答案为:ZnS;
②根据图知,每个S原子连接4个Zn原子,所以其配位数是4,
故答案为:4.
(1)D是Si元素,硅原子核外有14个电子,根据构造原理知,其基态原子核外电子排布式为:1S22S22P63S23P2,
故答案为:1S22S22P63S23P2;
(2)A、B、C、D分别是N、Na、Al、Si元素,同一周期中,元素的第一电离能随着原子序数的增大而呈增大趋势,同一主族中,元素的第一电离能随着原子序数的增大而减小,所以第一电离能:Na<Al<Si<P,P<N,
所以这几种元素的第一电离能大小顺序是:Na<Al<Si<N,
故答案为:Na<Al<Si<N;
(3)B的氯化物是NaCl,D的氯化物是SiCl4,氯化钠是离子晶体,四氯化硅是分子晶体,离子晶体的熔点大于分子晶体,故答案为:高;NaCl是离子晶体,SiCl4是分子晶体;
(4)E是S元素,SO3分子S原子含有3个σ键且不含孤电子对,所以为平面正三角形结构,三氧化硫分子中正负电荷重心重合,为非极性分子,故答案为:平面正三角形; 非极性;
(5)①E是S元素,F是Zn元素,S原子个数=8×
| 1 |
| 8 |
| 1 |
| 2 |
②根据图知,每个S原子连接4个Zn原子,所以其配位数是4,
故答案为:4.
点评:本题考查了物质结构和性质,正确推断元素是解本题关键,利用均摊法、元素周期律等知识点来分析解答,难点是S原子配位数的判断,难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目