题目内容
【题目】碘化亚铜(CuI)是阳极射线管复盖物、也是重要的有机反应催化剂,不溶于水和乙醇。下图是用废铜电缆(杂质中含有少量铁)制取无水碘化亚铜的流程。
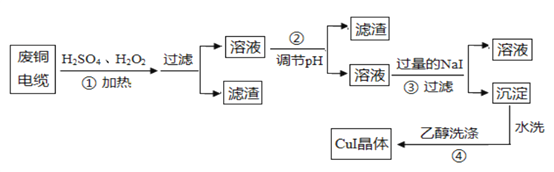
(1)过程①得到的溶液呈蓝色,其原因是_______________________(用化学方程式表示),当温度高于40℃时,反应的速度下降,原因是 _____________________ 。
(2)已知:Cu(OH)2的Ksp=2.2×10-20,Fe(OH)3的Ksp=2.16×10-39,lg6=0.78,过程②中用_____________调节溶液的pH值,
A.NaOH B.NH3·H2O C.CuO D.CuCO3
得到的滤渣成分是 __________ 。
(3)过程③的氧化产物能使淀粉变蓝,对应的离子方程式为 ________________ 。
(4)过程④用乙醇洗涤的目的为 _____________________________ 。
(5)准确称取m gCuI样品,加入足量的Fe2(SO4)3溶液中,写出该该反应的离子方程式____________________________________待样品完全反应后,用a mol/L酸性KMnO4溶液滴定,达到终点时,消耗的体积平均值为Vml,则样品中CuI的质量分数为 ____________ 。
(已知:5Fe2++MnO4- + 8H+ = 5Fe3+ + Mn2+ +4H2O)
【答案】 Cu+H2O2+H2SO4=CuSO4+2H2O 温度高于40℃使,H2O2分解,浓度减小,反应速率减小 CD Fe(OH)3 2Cu2++4I-=2CuI↓+I2 可得到干燥的CuI 2CuI + 4Fe3+ = 2Cu2+ + 4Fe2++I2 2.5×191aV×10-3/m
【解析】(1)、利用H2O2的氧化性,可以在硫酸溶液中将铜氧化成Cu2+使溶液呈蓝色,所以反应方程式是:Cu+H2O2+H2SO4=CuSO4+2H2O;因H2O2易受热分解,当温度高于40℃时,会使H2O2受热分解,造成H2O2浓度下降,反应速率减小。
(2)、调节PH值时用NaOH和NH3·H2O会分别引入Na+和NH4+杂质,而使用CuO和CuCO3不会引人杂质;因杂质Fe会发生:2Fe+3H2O2+6H+=2Fe3++6H2O,所以通过调节PH值可以使Fe3+生成Fe(OH)3而除去。所以此题答案为:CD;Fe(OH)3。
(3)、通过②中调节PH值除去Fe3+后,所得溶液中含有Cu2+,加入过量的NaI得到的氧化产物能使淀粉变蓝,说明生成了单质I2,则I-化合价升高体现还原性,所以Cu2+应该化合价降低体现氧化性,再根据所得沉淀经水洗和乙醇洗涤后是CuI晶体,说明Cu2+生成了CuI,所以反应的离子方程式是:2Cu2++4I-=2CuI↓+I2。
(4)、因CuI不溶于水和乙醇,利用乙醇易溶于水又易挥发,所以先用水洗去CuI表面的杂质后,再用乙醇洗涤,可以除去沉淀表面的水,得到干燥的CuI。
(5)、利用Fe3+的氧化性,可以将CuI氧化为Cu2+和I2,所以反应的离子方程式是:2CuI + 4Fe3+ = 2Cu2+ + 4Fe2++I2;加入酸性高锰酸钾,可以和样品完全反应后所得溶液中的Fe2+反应,离子反应方程式是:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O,则根据上述两个反应方程式可得如下关系:(设样品中CuI的物质的量是xmol)
1CuI ~ 2Fe2+ ~![]() MnO4-,
MnO4-,
1mol 0.4mol
xmol V×10-3L×amol/L
得CuI的物质的量x=2.5×V×10-3L×amol/L,所以CuI的质量是: m(CuI)= 2.5×V×10-3L×amol/L×191g/mol,所以样品中CuI的质量分数为2.5×191aV×10-3/m。

 名校课堂系列答案
名校课堂系列答案【题目】在如图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶.a和b分别是( )
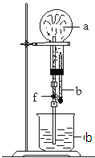
a(干燥气体) | b(液体) | |
① | NO2 | 水 |
② | CO2 | 4molL-1NaOH溶液 |
③ | Cl2 | 饱和食盐水 |
④ | NH3 | l molL-1盐酸 |
A. ①和② B. ③和④ C. ①和③ D. ②和④