题目内容
【题目】如下图所示,其中甲池的总反应式为2CH3OH + 3O2 + 4KOH===2K2CO3 + 6H2O,下列说法正确的是( )
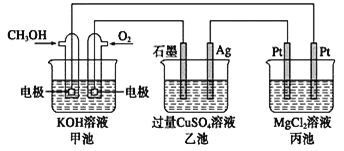
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+ 8H+
C. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
D. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度
【答案】C
【解析】
A、甲池是燃料电池,是化学能能转化为电能的装置,乙、丙池是电解池,是将电能能转化为化学能的装置,故A错误;B、在燃料电池中,负极是甲醇发生失电子的氧化反应,在碱性电解质下的电极反应为CH3OH-6e-+8OH-===CO32-+ 6H2O,故B错误;C、甲池中根据电极反应:O2+2H2O+4e-=4OH-,所以消耗280 mL (标准状况下0.0125mol)O2,则转移电子0.05mol,根据丙装置中,在阴极上是氢离子放电,减小的氢离子是0.025mol,所以镁离子和氢氧根离子之间反应生成氢氧化镁,理论上最多产生氢氧化镁质量应该是0.125![]() 2mol
2mol![]() 58g/mo=1,45g固体,所以C选项是正确的.D、电解池乙池中,电解后生成硫酸、铜和氧气,要想复原,要加入氧化铜,故D错误;答案:C。
58g/mo=1,45g固体,所以C选项是正确的.D、电解池乙池中,电解后生成硫酸、铜和氧气,要想复原,要加入氧化铜,故D错误;答案:C。

 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1,平衡常数为K1,反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2,平衡常数为K2,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q1_____0(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3.根据反应①与②推导出K1、K2、K3的关系式K3=_____,Q1、Q2、Q3的关系式Q3=_____,可推断反应③是_____(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有_____.
A.缩小容器体积 B.扩大容器的体积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况:
图甲中t2时刻改变的条件可能是_____,图乙中t2时刻改变的条件可能是_____.