题目内容
【题目】下画是18×7的格子,按要求作答.
(1)用X表示111号元素,在上表中标出
(2)F和H的最高价氧化物对应水化物反应的方程式;
(3)C、E、F的简单离子半径由小到大顺序是(填写离子符号);
(4)请用电子式表示出A和B形成的化合物形成过程:;
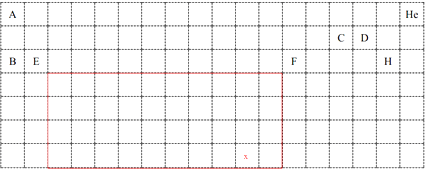
(5)用实线绘出过渡元素的边框.注意:不得使用铅笔作图 .
(6)只由D形成的18电子微粒 .
【答案】
(1)
(2)Al(OH)3+3HClO4=Al(ClO4)3+3H2O
(3)A13+<Mg2+<N3﹣
(4)![]()
(5)
(6)O ![]()
【解析】解:由元素在周期表中结构,可知A为氢、B为Na、C为氮、D为氧、E为Mg、F为Al、H为Cl.(1)第七周期中零族元素原子序数=18+18+18+32+32=118,则111号元素处于第七周期第11列,在周期表中位置: ,所以答案是:
,所以答案是:  ;(2)F和H的最高价氧化物对应水化物分别为Al(OH)3、HClO4 , 二者发生中和反应,反应方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,所以答案是:Al(OH)3+3HClO4=Al(ClO4)3+3H2O;(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,离子半径为:A13+<Mg2+<N3﹣ , 所以答案是:A13+<Mg2+<N3﹣;(4)A和B形成的化合物为NaH,属于离子化合物,应电子式表示形成过程为:
;(2)F和H的最高价氧化物对应水化物分别为Al(OH)3、HClO4 , 二者发生中和反应,反应方程式为:Al(OH)3+3HClO4=Al(ClO4)3+3H2O,所以答案是:Al(OH)3+3HClO4=Al(ClO4)3+3H2O;(3)电子层结构相同的离子,核电荷数越大离子半径越小,离子的电子层越多离子半径越大,离子半径为:A13+<Mg2+<N3﹣ , 所以答案是:A13+<Mg2+<N3﹣;(4)A和B形成的化合物为NaH,属于离子化合物,应电子式表示形成过程为: ![]() ,所以答案是:
,所以答案是: ![]() ;(5)短周期没有过渡元素,过渡元素为长周期中第3~12列元素,如图所示:
;(5)短周期没有过渡元素,过渡元素为长周期中第3~12列元素,如图所示:  ,所以答案是:
,所以答案是:  ;(6)只由氧形成的18电子微粒为O
;(6)只由氧形成的18电子微粒为O ![]() ,所以答案是:O
,所以答案是:O ![]() .
.

练习册系列答案
相关题目


