��Ŀ����
����Ŀ��t��ʱ��AgBr��ˮ�еij����ܽ�ƽ��������ͼ����֪t��ʱAgCl��Ksp��4.9��10��10������˵������ȷ����(����)

A. ͼ��a���Ӧ����AgBr�IJ�������Һ
B. ��t��ʱ��Ksp(AgBr)��4.9��10��13
C. ��t��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)��ƽ�ⳣ��K=1000
AgBr(s)��Cl��(aq)��ƽ�ⳣ��K=1000
D. ��AgBr�ı�����Һ�м���NaBr���壬��ʹ��Һ��b�㵽c��
���𰸡�D
��������A.����ͼ���֪����a��ʱQc=c(Ag+)��c(Br-)��Ksp(AgBr)������a��ΪAgBr�IJ�������Һ����A��ȷ��B.���ͼ��b��c(Ag+)��c(Br-)��֪�����¶���AgBr��Ksp(AgBr)=7��10-7��7��10-7��4.9��10��13����B��ȷ��C. ��t��ʱ��AgCl(s)��Br��(aq)![]() AgBr(s)��Cl��(aq)��ƽ�ⳣ��K=
AgBr(s)��Cl��(aq)��ƽ�ⳣ��K=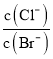 =
= 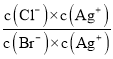 =
= 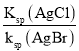 =
= ![]() =1000����C��ȷ��D. ��AgBr�ı�����Һ�м���NaBr���壬c(Br-)����ʹAgBr(s)
=1000����C��ȷ��D. ��AgBr�ı�����Һ�м���NaBr���壬c(Br-)����ʹAgBr(s)![]() Br��(aq)+ Ag+(aq)ƽ�������ƶ���c(Ag+)��С�����Բ�����ʹ��Һ��b�㵽c�㣬��D����ѡD��
Br��(aq)+ Ag+(aq)ƽ�������ƶ���c(Ag+)��С�����Բ�����ʹ��Һ��b�㵽c�㣬��D����ѡD��

����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ�أ�����YԪ��ԭ�Ӻ�������������������Ӳ�����3�������������ڱ��е����λ������ͼ��ʾ��
X | Y | |
Z | W |
��ش��������⣺
��1��Wλ�����ڱ��е����ڣ����壻
��2��X���γ�˫ԭ�ӷ��ӣ�����ӵĵ���ʽ����Y����Ԫ���γɵ�10�������г�����+1��������Ϊ���ѧʽ����ͬ����Z����Ԫ���γɵ�18�������г����ĩ�1��������Ϊ��
��3����ҵ�Ͻ������W����ͨ�����ڵ�Z�����п��Ƶû�����Z2W2 �� �����ʿ���ˮ��Ӧ����һ����ʹƷ����Һ��ɫ�����壬0.2mol�����ʲμӷ�Ӧʱת��0.3mol���ӣ�����ֻ��һ��Ԫ�ػ��ϼ۷����ı䣬д��Z2W2��ˮ��Ӧ�Ļ�ѧ����ʽ
��4����һ�������£���Ԫ��Y��Z��ɵ�һ����̬������ɷ�����������Ӧ����Ӧ��ƽ�����������̬���ʹ��棬��֪ÿת��4mol���ӷ���190.0kJ���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
