题目内容
【题目】下表是元素周期表的一部分,表中所列字母分别代表某一化学元素.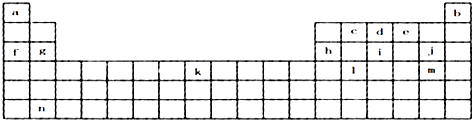
(1)上表所列元素中,原子最外层只有2个电子的短周期元素是(填元素符号);元素j的最高价氧化物的水化物的化学式为 , 元素i最高价氧化物的化学式为 .
(2)比较d、i的氢化物,d的熔沸点较高,原因是
(3)g的离子的结构示意图 , 元素c在周期表的位置
(4)已知与f在同一周期的元素R位于第p主族,以下可用p的代数式表示:则R的原子序数为 , R能形成气态氢化物,其氢化物的化学式为 .
(5)根据构造原理,写出m原子的核外电子排布式
【答案】
(1)Mg、He;HClO4;P2O5
(2)NH3存在分子间氢键
(3)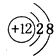 ;第二周期IVA族
;第二周期IVA族
(4)10+p;H8﹣pR
(5)[Ar]3d104s24p5
【解析】解:由元素周期表中位置,可知a是H,b是He,c是C,d是N,e是O,f是Na,g是Mg,h是Al,i是P,j是Cl,k是Fe,l是Ge,m是Br,n为Ba.(1)上表所列元素中,原子最外层只有2个电子的短周期元素是Mg、He,元素j的最高价氧化物的水化物为HClO4 , 元素i最高价氧化物为P2O5 , 所以答案是:Mg、He;HClO4;P2O5;(2)NH3存在分子间氢键,沸点比较高,所以答案是:NH3存在分子间氢键;(3)g的离子为Mg2+ , 离子核外电子数为10,离子结构示意图为  ;元素c在周期表的位置:第二周期IVA族, 所以答案是:
;元素c在周期表的位置:第二周期IVA族, 所以答案是:  ;第二周期IVA族;(4)已知与f在同一周期的元素R位于第p主族,则R的原子序数为10+p,R能形成气态氢化物,其氢化物的化学式为H8﹣pR,所以答案是:10+p;H8﹣pR;(5)m为Br,处于第四周期VIIA族,原子核外电子排布式为:[Ar]3d104s24p5 , 所以答案是:[Ar]3d104s24p5 .
;第二周期IVA族;(4)已知与f在同一周期的元素R位于第p主族,则R的原子序数为10+p,R能形成气态氢化物,其氢化物的化学式为H8﹣pR,所以答案是:10+p;H8﹣pR;(5)m为Br,处于第四周期VIIA族,原子核外电子排布式为:[Ar]3d104s24p5 , 所以答案是:[Ar]3d104s24p5 .

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案