题目内容
【题目】根据能量变化示意图,下列说法正确的是
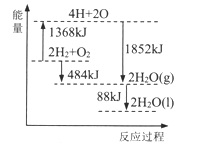
A. 拆开2molH2(g)和1molO2(g)中的化学键,共放出1368kJ能量
B. 1molH2和0.5molO2的能量之和比1molH2O(l)的能量大242kJ
C. 2H2O(g)=2H2(g)+O2(g) △H=484kJ/mol
D. 2H2(g)+O2(g)=2H2O(l) △H=572kJ/mol
【答案】C
【解析】A.拆化学键吸收能量;A项错误;B.根据图象数据分析计算,2molH2(g)和1molO2(g)反应生成2molH2O(l),共放出484+88=572kJ能量,则 1mol H2和0.5mol O2的能量之和比1molH2O(1)的能量大286kJ,B项错误;C.根据图象数据可知,2H2(g)+O2(g) =2H2O(g) △H=-484 kJ/mol,反应逆向进行,反应热的数值不变,符号相反,则2H2O(g)=2H2(g)+O2(g) △H=484 kJ/mol,C项正确;D.根据B项分析可知,2H2(g)+O2(g)=2H2O(1) △H=-572kJ/mol,D项错误。答案选C。

练习册系列答案
 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案
相关题目