题目内容
【题目】恒定温度为T1℃时,在容积为10 L的密闭容器中充人1.0mol X和0.80 mol Y,发生反应:2X(g) + Y(g) ![]() 2Z(g),X的转化率随时间的变化关系如右图所示。
2Z(g),X的转化率随时间的变化关系如右图所示。
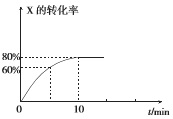
(1)第2 min时的反应速率v1(X)_________(填“大于”、“小于”或“等于”)第8 min时的反应速率可v2(X),原因是_________________。
(2)反应在0~10 min内Y的平均反应速率v(Y)=________mol.L-1.min-l。
(3)T1℃温度下反应的平衡常数K1为___________,若在第10 min后压缩容器容积,X的转化率_________(填“增大”、“减小”或“不变”,下同),平衡常数____________。
(4)若升高温度到T2℃( T2>T1),平衡时X的转化率减小,则该反应的△H______0(填 “大于”或“小于”)。
(5)不改变各物质起始量的情况下,无论如何改变条件,Y的转化率一定小于____________。
【答案】(1)大于,随反应进行,X的浓度逐渐减小;(2)0.004;(3)400,增大,不变;(4)小于;(5)62.5%。
【解析】
试题分析:(1)浓度对化学反应速率的影响,浓度越大反应速率越快,随着反应的进行,化学反应速率降低,因此第2min的v1(X)>v2(X);(2)此时间段内消耗X的物质的量为1×80%mol=0.8mol,消耗的Y的物质的量为0.8/2mol=0.4mol,根据化学反应速率的表达式,v(B)=0.4/(10×10) mol/ (L·min) = 0.004 mol/(L·min);
(3) 2X(g)+Y(g)![]() 2Z(g)
2Z(g)
起始: 1 0.8 0
变化: 2x x 2x
平衡:1-2x 0.8-x 2x
达到平衡时,消耗的B的物质的量为0.4mol,达到平衡是c(X)=(1-2×0.4)/10mol·L-1=0.02mol·L-1,c(B)=(0.8-0.4)/10mol·L-1=0.04mol·L-1,c(Z)=2×0.4/10mol·L-1=0.08mol·L-1,根据化学平衡常数的表达式,K=0.082/[0.04×0.022]=400,压缩体积,增大压强,平衡向体积减小的方向移动,即向正反应方向移动,X的转化率增大,化学平衡常数只受温度的影响,因此增大压强,平衡常数不变;(4)升高温度,X的转化率降低,说明反应向逆方向移动,根据勒夏特列原理,正反应方向是放热反应,即△H<0;(5)根据量的投入,X是不足,假设X全部转化,则消耗B的物质的量为1/2mol=0.5mol,此时B的转化率为0.5/0.8×100%=62.5%,此反应是可逆反应,不能进行到底,因此B的转化率一定小于62.5%。

 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案