题目内容
已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O?CH3COO-+H3O+ K1=1.75×10-5
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10
现有50mL 0.2mol?L-1醋酸与50mL 0.2mol?L-1醋酸钠混合制得溶液甲,下列叙述正确的是( )
CH3COOH+H2O?CH3COO-+H3O+ K1=1.75×10-5
CH3COO-+H2O?CH3COOH+OH- K2=5.71×10-10
现有50mL 0.2mol?L-1醋酸与50mL 0.2mol?L-1醋酸钠混合制得溶液甲,下列叙述正确的是( )
分析:A.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性;
B.电离、水解均为吸热反应;
C.醋酸与醋酸钠为缓冲溶液;
D.加入盐酸,酸性增强,但醋酸的电离常数只与温度有关.
B.电离、水解均为吸热反应;
C.醋酸与醋酸钠为缓冲溶液;
D.加入盐酸,酸性增强,但醋酸的电离常数只与温度有关.
解答:解:A.由K的关系可知,醋酸和醋酸钠的混合溶液中,电离大于水解,溶液显酸性,pH<7,故A错误;
B.电离、水解均为吸热反应,则对甲进行微热,K1、K2同时增大,故B正确;
C.醋酸与醋酸钠为缓冲溶液,则若在甲中加入少量的NaOH溶液,溶液的pH几乎不变,故C正确;
D.加入盐酸,酸性增强,但醋酸的电离常数只与温度有关,则溶液中醋酸的K1不变,故D错误;
故选BC.
B.电离、水解均为吸热反应,则对甲进行微热,K1、K2同时增大,故B正确;
C.醋酸与醋酸钠为缓冲溶液,则若在甲中加入少量的NaOH溶液,溶液的pH几乎不变,故C正确;
D.加入盐酸,酸性增强,但醋酸的电离常数只与温度有关,则溶液中醋酸的K1不变,故D错误;
故选BC.
点评:本题考查弱电解质的电离及盐类水解,明确电离与水解的程度及K的影响因素即可解答,选项C缓冲溶液为解答的难点,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
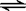 CH3COO—+H3O+
K1=1.75×10-5
CH3COO—+H3O+
K1=1.75×10-5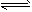 CH3COO-+H3O+ K1=1.75×10-5
CH3COO-+H3O+ K1=1.75×10-5 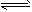 CH3COOH+OH- K2 =5.71×10-10
CH3COOH+OH- K2 =5.71×10-10