题目内容
下列排列顺序正确的是
| A.常温下水电离出的c(H+):pH =5的CH3COOH溶液>pH =5的盐酸 |
| B.微粒半径:Fe(OH)3胶粒>K+>C1->Na+ |
| C.等温度等物质的量浓度溶液的pH:Na2CO3>苯酚钠>NaHCO3 |
| D.氢化物的沸点:H2Se>H2S>H2O |
C
试题分析:A选项中PH=-lgc(H+),当CH3COOH溶液和盐酸PH=5,c(H+)一定相等;B选项中K+和C1-核外电子数都是20,核电荷数越大,离子半径越小,因此微粒半径:Fe(OH)3胶粒>C1->K+>Na+;D选项中氧的氢化物水由于含有氢键,沸点较硫、硒氢化物高,硫化氢、氢化硒是分子化合物,比较式量知硫化氢的沸点低于硒化氢,因此氢化物的沸点:H2O>H2Se>H2S
点评:本次考查的知识点较多,涉及到溶液的PH,粒子半径的比较,物质沸点的比较等,信息量较大,对于物质的性质比较应该落到比较物质的结构,因为化学中结构决定性质。

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目

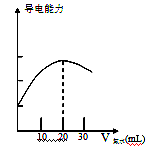

 Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是
Ba2++2OH-向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是