题目内容
(12分)(1)某研究性学习小组在实验室中配制1 mol/L的稀硫酸标准溶液,然后用其滴定某未知浓度的NaOH溶液。下列有关说法中正确的是______________。
A、实验中所用到的滴定管、容量瓶,在使用前均需要检漏;
B、如果实验中需用60 mL 的稀硫酸标准溶液,配制时应选用100 mL容量瓶;
C、容量瓶中含有少量蒸馏水,会导致所配标准溶液的浓度偏小;
D、酸式滴定管用蒸馏水洗涤后,即装入标准浓度的稀硫酸,则测得的NaOH溶液的浓度将偏大;
E、配制溶液时,若在最后一次读数时俯视读数,则导致最后实验结果偏大。
F、中和滴定时,若在最后一次读数时俯视读数,则导致最后实验结果偏大。
(2)常温下,已知0.1 mol·L-1一元酸HA溶液中c(OH-) / c(H+)=1×10-8。
①常温下,0.1 mol·L-1 HA溶液的pH= ;写出该酸(HA)与NaOH溶液反应的离子方程式: ;
②pH=3的HA与pH=11的NaOH溶液等体积混合后,溶液中4种离子物质的量浓度大小关系是: ;
③0.2 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合后所得溶液中:
c(H+)+c(HA)-c(OH-)= mol·L-1。(溶液体积变化忽略不计)
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则该温度下水的离子积常数Kw= 。
①该温度下(t℃),将100 mL 0.1 mol·L-1的稀H2SO4溶液与100 mL 0.4 mol·L-1的NaOH溶液混合后(溶液体积变化忽略不计),溶液的pH= 。
②该温度下(t℃),1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则稀硫酸的pH(pHa)与NaOH溶液的pH(pHb)的关系是: 。
(12分)(1)ABD (2分)
(2) ①3 HA+OH ===A
===A +H2O ②c(A
+H2O ②c(A )>c(Na+)>c(H+)>c(OH
)>c(Na+)>c(H+)>c(OH ) ③0.05 各1分
) ③0.05 各1分
(3)10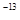 (2分) ①12 (2分) ②pHa+pHb=12(2分)
(2分) ①12 (2分) ②pHa+pHb=12(2分)
解析试题分析:(1)容量瓶中含有少量蒸馏水,不会影响溶质和溶剂的质量,所以不影响实验结果,C不正确;配制溶液时,若在最后一次读数时俯视读数,则浓硫酸的体积偏小,导致最后实验结果偏低,D不正确;中和滴定时,若在最后一次读数时俯视读数,则消耗硫酸的体积减小,导致最后实验结果偏小,F不正确,其余选项都是正确的,答案选ABD。
(2) ①根据水的离子积常数可知,如果c(OH-) / c(H+)=1×10-8,则溶液中OH-离子浓度是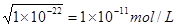 。则氢离子浓度是0.001mol/L,所以pH=3,这说明HA是弱酸,所以和氢氧化钠反应的离子方程式是HA+OH
。则氢离子浓度是0.001mol/L,所以pH=3,这说明HA是弱酸,所以和氢氧化钠反应的离子方程式是HA+OH ===A
===A +H2O。
+H2O。
②由于HA是弱酸,所以pH=3的HA溶液的浓度大于0.001mol/L,则在和氢氧化钠的反应中HA是过量的,因此反应后溶液显酸性,则离子浓度大小顺序是c(A )>c(Na+)>c(H+)>c(OH
)>c(Na+)>c(H+)>c(OH ) 。
) 。
③0.2 mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合后,酸是过量的,所以根据电荷守恒定律和物料守恒可知,c(Na+)+c(H+)=c(OH )+c(A
)+c(A )、2c(Na+)=c(HA)+c(A
)、2c(Na+)=c(HA)+c(A )。则c(H+)+c(HA)-c(OH-)=c(Na+)=0.05mol/L。
)。则c(H+)+c(HA)-c(OH-)=c(Na+)=0.05mol/L。
(3)t℃时,有pH=2的稀硫酸和pH=11的NaOH溶液等体积混合后溶液呈中性,则0.01=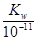 ,解得该温度下水的离子积常数Kw=10
,解得该温度下水的离子积常数Kw=10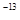 。
。
①硫酸和氢氧化钠的物质的量是0.01mol和0.04mol,则氢氧化钠是过量的,所以溶液中OH-浓度是(0.04mol-0.02mol)÷0.2L=0.1mol/L,则溶液中氢离子浓度是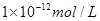 ,即pH=12。
,即pH=12。
②1体积的稀硫酸和10体积的NaOH溶液混合后溶液呈中性,则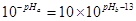 ,解得pHa+pHb=12。
,解得pHa+pHb=12。
考点:考查中和滴定的实验操作、误差分析溶液中离子浓度大小比较及pH的有关计算等
点评:在比较溶液中离子浓度大小时,应该充分利用好电荷守恒定律、质子守恒以及物料守恒等关系式。其次在利用水的离子积常数进行有关计算时,必需注意水的离子积常数与温度有关系,由于电离是吸热的,所以水的离子积常数随温度的升高而增大,只有在常温常压下pH=7的溶液才是显酸性的。

 名校课堂系列答案
名校课堂系列答案