题目内容
【题目】按要求进行计算,直接写出计算结果:
(1)标准状况下,2.24 L Cl2的质量为__________;有__________个氯原子。
(2)10.8g R2O5中氧原子的数目为3.01×1023, 则元素R的相对原子质量为__________;R元素名称是__________。
(3)阻燃剂碱式碳酸铝镁中OH-与CO32﹣质量之比为51:300,则这两种离子的物质的量之比为____________。
(4)如果a g某气体中含有的分子数为b,则c g该气体在标准状况下的体积是(设NA为阿伏加德罗常数)______________。
(5)将10 mL 1.00 mol/L Na2CO3溶液与10 mL 1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为__________,则混和溶液中Cl-的物质的量浓度为__________(忽略混合前后溶液体积的变化)。
(6)标准状况下,3.4g NH3 的体积为_______ ;它与标准状况下_______ L H2S含有相同数目的氢原子。
(7)已知CO、CO2混合气体的质量共11.6g,在标准状况下的体积为6.72L,则混合气体中CO的质量为_______ ;CO2在相同状况下的体积为_______ 。
(8)由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍。则该混合气体中CH4和O2的体积比为_______。
【答案】7.1 g0.2 NA14氮3:5![]() 1.0 mol/L1.0 mol/L4.48 L6.72 L2.8 g4.48 L3:13
1.0 mol/L1.0 mol/L4.48 L6.72 L2.8 g4.48 L3:13
【解析】
(1)标准状况下, 2.24 L Cl2的质量为m=2.24 L /22.4L![]() mol
mol![]() 71g/mol=7.1g;含有氯原子数为N=2.24 L /22.4L
71g/mol=7.1g;含有氯原子数为N=2.24 L /22.4L![]() mol
mol![]() 2NA=0.2 NA。子因此,本题答案是:7.1;0.2 NA。
2NA=0.2 NA。子因此,本题答案是:7.1;0.2 NA。
(2) 设元素的相对原子质量为ag,则R2O5中氧原子的数目为: 10.8/(2a+80)![]() 6.02
6.02![]() 1023解答a=14所以,R为氮元素;因此,本答案是:14;氮。
1023解答a=14所以,R为氮元素;因此,本答案是:14;氮。
(3)设阻燃剂碱式碳酸铝镁中 OH-与CO32﹣的质量分别为51g:300g,则二者物质的量之比为:51/17:300/60=3:5;因此,答案是: 3:5。
(4) ag该气体的物质的量为n=b/NAmol,所以cg该气体的物质的量为n=bc/aNAmol,所以在标准状况下占有的体积应表示为. ![]() 。
。
(5)将10 mL 1.00 mol/L Na2CO3溶液与10 mL 1.00 mol/L CaCl2溶液相混和,则混和溶液中Na+的物质的量浓度为: (10 mL ![]() 1.00 mol/L
1.00 mol/L ![]() 2)/ (10 mL+10 mL )= 1.0 mol/L ;因此,答案是: 1.0 mol/L 。
2)/ (10 mL+10 mL )= 1.0 mol/L ;因此,答案是: 1.0 mol/L 。
(6) 标准状况下,3.4g NH3 的体积为(3.4g /17gmol-1![]() 22.4L
22.4L![]() mol -1=4.48L;设它与标准状况下VL H2S含有相同数目的氢原子,则VL/22.4L
mol -1=4.48L;设它与标准状况下VL H2S含有相同数目的氢原子,则VL/22.4L![]() mol -1
mol -1![]() 2=3.4g /17gmol-1
2=3.4g /17gmol-1![]() 3,V= 6.72 L。答案:6.72 L。
3,V= 6.72 L。答案:6.72 L。
(7)标准状况下体积为6.72L,则混合气体的物质的量为6.72L/22.4L![]() mol -1 =0.3mol。设CO、CO2的物质的量分别为x、y,则x+y=0.3 28x+44y=11.6,解得x=0.1mol,y=0.2mol。CO的质量为0.1mol×28g/mol=2.80g,CO2在标准状况下的体积为0.2mol×22.4L/mol=4.48L。故答案为:2.8 4.48 L。
mol -1 =0.3mol。设CO、CO2的物质的量分别为x、y,则x+y=0.3 28x+44y=11.6,解得x=0.1mol,y=0.2mol。CO的质量为0.1mol×28g/mol=2.80g,CO2在标准状况下的体积为0.2mol×22.4L/mol=4.48L。故答案为:2.8 4.48 L。
(8) 由CH4和O2的组成的混和气体,在标况下的密度是H2的14.5倍,则混合气体的平均摩尔质量为29。设含CH4为xmol,含O2为ymol,则(16x+32y)/(x+y)=29,解x/y=3:13,根据阿伏伽德罗定律,所以混合气体中CH4和O2的体积比为3:13。答案:3:13。

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000℃,可能的原因是___________________________________________。
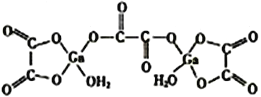
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。
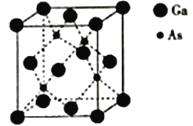
(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。
【题目】(在Na+浓度为0.5 mol/L的某澄清溶液中,还可能含有下表中的若干种离子。(已知H2SiO3为不溶于水的胶状沉淀,加热时易分解为两种氧化物)
阳离子 | K+ | Ag+ | Ca2+ | Ba2+ |
阴离子 | NO3- | CO32- | SiO32- | SO42- |
现取该溶液100mL进行如下实验(气体体积在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 生成白色胶状沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ中产生的混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题:
(1)实验Ⅰ能确定一定不存在的离子是________;
(2)实验Ⅰ中生成气体的离子方程式为________;
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)_____。
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c(mol/L) | 0.25mol/L |
(4)判断K+是否存在,若存在,其最小浓度为________,若不存在,请说明理由:________。