题目内容
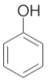
【题目】以![]() 为原料制取
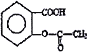
为原料制取![]() ,是化工生产环己酮的基本原理,根据下列合成路线填空:
,是化工生产环己酮的基本原理,根据下列合成路线填空:
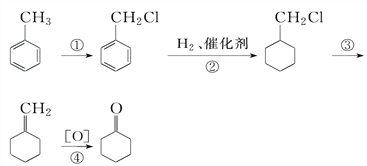
(1)反应①的条件是___________________________________________________,反应③的条件是_____________________________________________________。
(2)写出反应②③④的化学方程式并注明反应类型:
②________________________________________________________;
③____________________________________________________________;
④_________________________________________________________
【答案】 光照 NaOH的醇溶液,加热 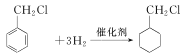 ,加成反应
,加成反应 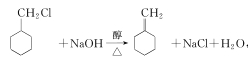 ,消去反应
,消去反应 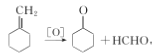 ,氧化反应
,氧化反应
【解析】根据题中各物质转化关系,甲苯与氯气在光照条件下发生侧链上取代生成![]() ,
,![]() 与氢气发生加成反应生成
与氢气发生加成反应生成 ,
, 在氢氧化钠醇溶液中加热发生消去反应生成
在氢氧化钠醇溶液中加热发生消去反应生成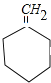 ,
, 发生氧化反应生成
发生氧化反应生成![]() ;
;
(1)根据上面的分析可以知道,反应①的条件是光照,反应③的条件是氢氧化钠醇溶液、加热;正确答案是:光照;氢氧化钠醇溶液、加热。
(2)反应②为![]() 与氢气发生加成反应,化学方程为
与氢气发生加成反应,化学方程为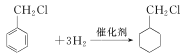 ;正确答案:
;正确答案: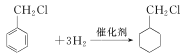 ;加成反应。
;加成反应。
反应③为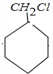 在氢氧化钠的醇溶液中,加热,发生消去反应,化学方程为
在氢氧化钠的醇溶液中,加热,发生消去反应,化学方程为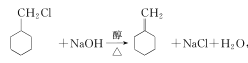 ;正确答案:
;正确答案: ,消去反应。
,消去反应。
反应④为 发生氧化反应生成酮,化学方程为
发生氧化反应生成酮,化学方程为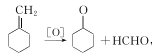 ;正确答案:
;正确答案: ;氧化反应。
;氧化反应。

 口算能手系列答案
口算能手系列答案【题目】某实验小组用0.50 mol·L-1NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。若实验中大约要使用245mL0.50 mol·L-1NaOH溶液,
(1)配制时至少需要用托盘天平称量NaOH固体_________g。
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,下列说法正确的是_________
A.如图所示,测定中和热时,大小两烧杯间填满碎纸条或泡沫塑料的目的是固定小烧杯

B.若用50 mL 0.55 mol·L1的氢氧化钠溶液,分别与50 mL 0.50 mol·L1的盐酸和50 mL 0.50 mol·L1的硫酸充分反应,两反应测定的中和热相等
C.中和热测定实验也可以用稀硫酸与氢氧化钡溶液反应
D.为了简化装置,中和热测定实验中的环形玻璃搅拌棒可以由温度计代替
(3)写出该反应中和热的热化学方程式:(中和热为ΔH=-57.3 kJ·mol-1)_____________________。
(4)取50 mLNaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
试验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
①表中的温度差平均值为___________________℃。
②近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c = 4.18 J·(g·℃)-1。则中和热ΔH=________________(取小数点后一位)。
③上述实验数值结果与ΔH=-57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)__________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】某化学兴趣小组的同学探究KI的化学性质。
(1)KI组成中含有钾元素,可知它能发生__________反应。
(2)①根据碘元素的化合价可推知KI有__________性。
②与KI反应,能体现上述性质的试剂有_________(填序号)
a、Fe2+ b、Fe3+ c、Br- d、Cl2
(3)兴趣小组的同学们猜测:Cu2+有可能氧化I-,为了验证,他们做了如下实验。(已知:CuI为不溶于水的白色沉淀)
操作 | 现象 |
| 溶液分层,上层显紫色,有白色沉淀生成 |
结论:Cu2+_________(填能或不能)氧化I-。若能氧化,写出反应的离子方程式_____________________ (若认为不能氧化,此空不用填写)。
(4)①同学们依据(3)的结论推测:Ag+能氧化I-,原因为___________。
他们做了如下实验进行探究
实验一:
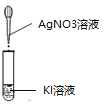
操作 | 现象 |
| 生成黄色沉淀 |
②发生反应的化学方程式为_________________________________。
实验二:
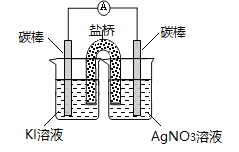
操作 | 现象 |
| 3分钟后KI溶液开始变黄,随后溶液黄色加深,取出该烧杯中溶液滴入盛有淀粉溶液的试管,溶液变蓝。 |
③甲同学认为根据上述实验现象不能说明Ag+能氧化I-,原因是_______________________________。
乙同学在上述实验基础上进行了改进,并得出结论:Ag+能氧化I-。发生反应的离子方程式为____________________________________。
由以上两个实验得出的结论为________________________________。