题目内容
10.下图所示的实验,能达到实验目的是( )| A | B | C | D |
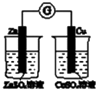 | 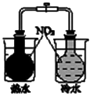 | 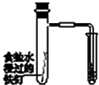 | 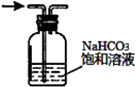 |
| 验证化学能转化为电能 | 证明温度对平衡移动的影响 | 验证贴发生析氢腐蚀 | 除去氯气中的HCl气体 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.不能形成闭合回路;
B.2NO2?N2O4△H<0,升高温度或降低温度,该反应都发生平衡移动导致气体颜色发生变化;
C.食盐水为中性,发生吸氧腐蚀;
D.氯气、HCl均与碳酸氢钠溶液反应.
解答 解:A.不能形成闭合回路,不能形成原电池,则不能验证化学能转化为电能,故A错误;
B.2NO2?N2O4△H<0,升高温度或降低温度,该反应都发生平衡移动导致气体颜色发生变化,温度不同导致两个烧瓶中气体颜色不同,所以可以实现实验目的,故B正确;
C.食盐水为中性,发生吸氧腐蚀,不发生析氢腐蚀,故C错误;
D.氯气、HCl均与碳酸氢钠溶液反应,不能除杂,应选饱和食盐水除杂,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及原电池、化学平衡、混合物分离提纯等,把握反应原理、实验装置的作用等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
1.将X和Y加入密闭容器中,在一定条件下发生反应:X(g)+Y(s)?2Z(g)+W(s).忽略固体所占体积,平衡时Z的体积分数(%)随温度和压强的变化如表所示.
请回答下列问题:
(1)该反应的△S>(填“>”、“<”或“=”,下同)0;△H>0.
(2)表中该反应的化学平衡常数的值最大时对应的温度是1000℃;判断理由是该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大.
(3)在915℃、2.0MPa时X的平衡转化率为60%.
(4)用压强替代浓度得到的平衡常数叫作压强平衡常数(Kp).在810℃、1.0MPa下,Kp=0.634MPa.
(5)能同时提高X的反应速率和转化率的措施是A.
A.升高温度 B.增大压强 C.加催化剂 D分离Z.
| 压强/MPa 体积分数/% 温度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1000 | e | f | 85.0 |
(1)该反应的△S>(填“>”、“<”或“=”,下同)0;△H>0.
(2)表中该反应的化学平衡常数的值最大时对应的温度是1000℃;判断理由是该反应的正反应为吸热反应,升高温度平衡正向移动,平衡常数增大.
(3)在915℃、2.0MPa时X的平衡转化率为60%.
(4)用压强替代浓度得到的平衡常数叫作压强平衡常数(Kp).在810℃、1.0MPa下,Kp=0.634MPa.
(5)能同时提高X的反应速率和转化率的措施是A.
A.升高温度 B.增大压强 C.加催化剂 D分离Z.
18.下列物质中,属于烃的是( )
| A. | CH2Cl2 | B. | H2S | C. | CH3COOH | D. | CH3CH2CH2CH2CH3 |
5.下列图示实验操作正确的是( )
| A. |  除去CL2中的HCL | B. |  电解制CL2和H2 | C. | 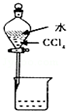 分离CCL4和水 | D. |  中和热的测定 |
15.下列实验过程中产生的现象与对应的图形相符的是( )
| A. |  NaHSO3 粉末加入HNO3溶液中 | B. |  SO2气体通入H2S溶液中 | ||
| C. |  NaOH溶液滴入Ca(HCO3)2溶液中 | D. |  CO2气体通入NaOH溶液中 |
2.根据甲和乙两个对应的物理量,不能求出物质的量的是( )
| 选项 | 甲 | 乙 |
| A | 物质中的粒子数 | 阿伏加德罗常数 |
| B | 固体体积 | 固体密度 |
| C | 溶液中溶质的物质的量浓度 | 溶液体积 |
| D | 标准状况下气体摩尔体积 | 标准状况下气体体积 |
| A. | A | B. | B | C. | C | D. | D |
19.下列物质按纯净物、混合物、电解质、非电解质的顺序组合的一组为( )
| A. | 生石灰、漂白粉、氯化铜、碳酸钠 | B. | 胆矾、盐酸、铁、碳酸钙 | ||
| C. | 蒸馏水、氨水、碳酸氢钠、二氧化硫 | D. | 纯盐酸、空气、硫酸、干冰 |
20.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 标准状况下,22.4LH2O含有的水分子数为NA | |
| B. | 标准状况下,22.4 L的任何物质的物质的量都约是1 mol | |
| C. | 通常状况下,11.2LCO2的分子数为0.5NA | |
| D. | 常温常压下,0.62g Na2O含有的Na+离子数为0.02 NA |
 A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题:
A,B,C,D,E是原子序数依次增大的五种短周期元素,A是半径最小的元素,C是半径最大的元素.B和D分别为同主族,且D的质子数是B的2倍,A与E形成的化合物的化学式为AE,其分子中含18个电子,请回答下列问题: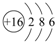 .
.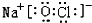 ,这种化合物中所含的化学键类型有离子键、共价键.
,这种化合物中所含的化学键类型有离子键、共价键.