题目内容
分别依据下列实验事实,得出的结论正确的是
实验事实 | 结论 | |
A | 将通入溴水中二氧化硫,溴水褪色 | 二氧化硫有漂白性 |
B | 淀粉与稀硫酸共热,再加银 | 淀粉没有水解 |
C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 向1mL 0.1 mol/L的AgNO3溶液中加入1 mL 0.1 mol/L NaCl溶液,出现白色沉淀,再加几滴0.1 mol/L Na2S溶液,有黑色沉淀生成 | 氯化银的溶解度大于硫化银 |
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 氨溶液水浴加热,无银镜生成
氨溶液水浴加热,无银镜生成

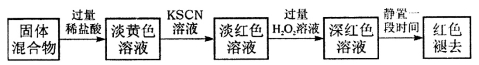
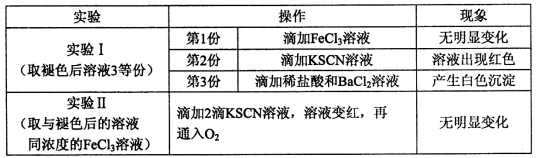
 滴加氨水至中性,溶液中的溶质只有氯化铵
滴加氨水至中性,溶液中的溶质只有氯化铵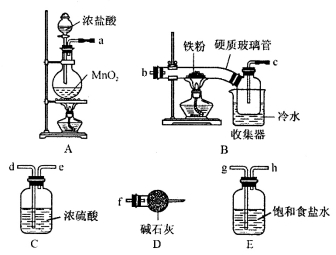
 水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。
水氯化铁在空气中易潮解,加热易升华;②工业上,向500—600℃的铁屑中通入氯气可生产无水氯化铁;③向炽热铁屑中通入氯化氢可以生产无水氯化亚铁和氢气。