题目内容
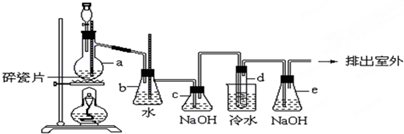
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度 ,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用图所示装置制备1,2-二溴乙烷.其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
填写下列空白:
(1)写出本题中制备l,2-二溴乙烷的两个化学反应方程式________.
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞.请写出发生堵塞时瓶b中的现象:________.
(3)容器c中NaOH溶液的作用是________.
(4)某学生在做此实验时,使用一定量的液溴,当溴全部褪色时,所消耗乙醇和浓硫酸混合液的量比正常情况下超过许多.如果装置的气密性没有问题,试分析其可能的原因.
答案:略
解析:
解析:
|
(1) 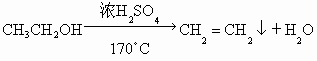 ; ;
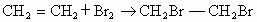
(2)b中水面下降,玻璃管中水柱上升,甚至溢出 (3)除去乙烯中带出的酸性气体 (4)①乙烯的生成速率过快,②实验中,乙醇和浓硫酸混合液没有迅速达到170℃ (1)实验室制备1,2-二溴乙烷是由乙醇在浓硫酸存在下制取乙烯,再由乙烯与溴反应制取的.在书写制备乙烯的方程式时一定要标上温度(170℃). (2)因为1,2-二溴乙烷的熔点(9.79℃)较低,所以当试管外的冷水温度低于此熔点时,1,2-二溴乙烷会在试管d中凝固,从而发生堵塞现象,使试管d和容器a、b中的压强增大,将安全瓶b内的水压入长玻璃管,使玻璃管中水柱上升甚至溢出,同时b中水面略有下降. (3)在制乙烯的过程中,浓硫酸不但是催化剂、脱水剂,也是氧化剂,在反应过程中容易将乙醇氧化生成C,然后继续反应生成  、 、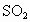 ,导致主产物乙烯中混有 ,导致主产物乙烯中混有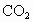 和 和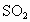 气体.因此瓶c内用NaOH溶液洗涤乙烯气体的目的是为了除去乙烯中带出的酸性气体. 气体.因此瓶c内用NaOH溶液洗涤乙烯气体的目的是为了除去乙烯中带出的酸性气体.
(4)乙醇和浓硫酸反应制乙烯的过程中,如果温度不能迅速升至170℃,过多地停留在140℃左右,将会有较多的乙醚生成;若温度过高,则乙醇与浓硫酸间又发生氧化还原反应生成较多的酸性气体等副产品,这些都会造成原料消耗过多.本实验中如果乙烯产生得过快,乙烯将会来不及充分反应而逸出,从而也使原料的消耗增大. |

练习册系列答案
相关题目

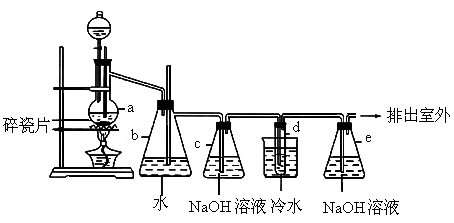
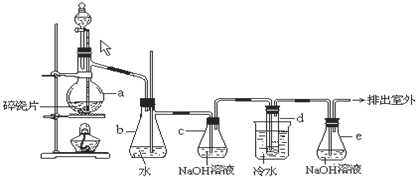 1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g?cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用如图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).
1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度2.18g?cm-3,沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂.在实验室中可以用如图所示装置制备1,2-二溴乙烷,其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水).