题目内容
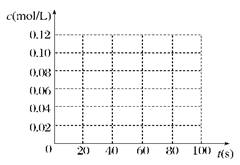
(1)某温度时,在2L密闭容器中,X、Y、Z三种物质的物质的量随时间变化的曲线如图所示。由图中数据分析:

①该反应的化学方程式: ;
②反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
③3min后图中曲线所表示的含义是 。
(2)(4分)下图为石油蒸馏的装置图,根据此图回答下列问题。
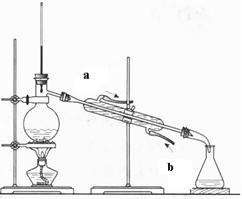
①温度计的水银球插在什么位置?
②蒸馏烧瓶中除了加入石油外还要加入什么?
③冷却水的流动方向如何?(填A或B,下题同)
A、a→b B、 b→a
④得到的汽油、煤油是纯净物吗?
A、是 B、不是

①该反应的化学方程式: ;
②反应开始至2min末,X的反应速率为 (mol·L-1·min-1);
③3min后图中曲线所表示的含义是 。
(2)(4分)下图为石油蒸馏的装置图,根据此图回答下列问题。

①温度计的水银球插在什么位置?
②蒸馏烧瓶中除了加入石油外还要加入什么?
③冷却水的流动方向如何?(填A或B,下题同)
A、a→b B、 b→a
④得到的汽油、煤油是纯净物吗?
A、是 B、不是
(10分)(1)(6分)①Y+2Z 3X ②0.1
3X ②0.1
③在此条件下该反应已达到化学反应限度(或化学平衡)
(2)(4分)①温度计的水银球插在蒸馏烧瓶支管口处
②还要加入沸石或碎瓷片
③B、 ④B、
 3X ②0.1
3X ②0.1③在此条件下该反应已达到化学反应限度(或化学平衡)
(2)(4分)①温度计的水银球插在蒸馏烧瓶支管口处
②还要加入沸石或碎瓷片
③B、 ④B、
(1)根据图像可知,反应进行到3min时,各种物质的物质的量不再发生变化,说明反应达到平衡状态。此时X增加了0.6mol,Y、Z分别减少0.2mol和0.4mol.应用物质的量的变化量之比是相应的化学计量数之比,因此方程式为Y+2Z 3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是
3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是 。
。
(2)①蒸馏时温度计测量的是气体的温度,所以温度计的水银球插在蒸馏烧瓶支管口处。
②在加热的条件下,液体容易剧烈跳动,所以需要加入碎瓷片防止暴沸。
③冷凝时水的流向应该和气体的流向相反,所以是b进a出,己答案选B。
④石油的分馏产物仍然是混合物,答案选B。
 3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是
3X。反应开始至2min末,X的物质的量增加了0.4mol,所以其反应速率是 。
。(2)①蒸馏时温度计测量的是气体的温度,所以温度计的水银球插在蒸馏烧瓶支管口处。
②在加热的条件下,液体容易剧烈跳动,所以需要加入碎瓷片防止暴沸。
③冷凝时水的流向应该和气体的流向相反,所以是b进a出,己答案选B。
④石油的分馏产物仍然是混合物,答案选B。

练习册系列答案
 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案
相关题目

 2YX3(g) △H
2YX3(g) △H 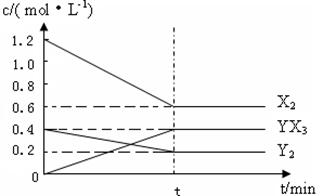
 2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。
2Z(g),达到平衡时,平衡混合气体中Z的体积分数为0.5。 C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
C6H5CH=CH2(g)+H2 (g) ?△H=+125kJ·mol-1
 2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( )
2SO3,这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中,错误的是( ) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表: H+ + In—(aq)
H+ + In—(aq)