题目内容
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实数室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。
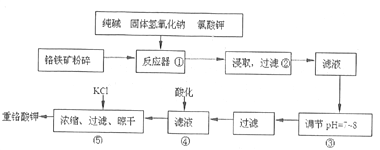
涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O。
12Na2CrO4+3Fe2O3+7KC1+12H2O。
(1)进入反应器①之前将铬铁矿粉碎的目的是____________________________。
(2)步骤②过滤得到的滤渣主要成分是_______________。过滤所需的玻璃仪器有_________________。
(3)操作④中酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________________。
(4)操作③调节溶液pH=7~8的目的是_________________________。
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72-的废水,原理示意图如下图。

B为电解池的________极,写出阳极的电极反应式____________________。阳极区域溶液中发生反应的离子方程式为____________________________________。为了使Cr3+和Fe3+转化为Fe(OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=1.0×10-12mo1·L-1,则溶液中c(Cr3+)=_________mo1·L-1。{已如Ksp[Fe(OH)3]=4.0×10-28,Ksp[Cr(OH)3]=6.0×10-31}
【答案】 增大接触面积,从而加快化学反应速率和提高原料的利用率 Fe2O3 烧杯、漏斗、玻璃棒 2CrO42-+2H+![]() Cr2O72-+H2O 将硅酸根离子和偏铝酸根离子转化为沉淀而除去 阴 Fe-2e-= Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1.5×10﹣5
Cr2O72-+H2O 将硅酸根离子和偏铝酸根离子转化为沉淀而除去 阴 Fe-2e-= Fe2+ Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 1.5×10﹣5
【解析】试题分析:(1)将铭铁矿粉碎的作用是增大接触面积;(2)在反应器中主要发生6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3与NaOH反应分别转化为Na2SiO3和NaAlO2,产物中只有Fe2O3难溶于水;根据过滤装置分析所需的玻璃仪器;(3)操作④中酸化时,CrO42-转化为Cr2O72-,根据元素守恒、电荷守恒配平转化的离子方程式;(4)调节溶液pH=7~8可以将硅酸根离子和偏铝酸根离子转化为沉淀而除去;(5)B电极生成氢气,所以B是阴极;阳极生成Fe2+,阳极区域溶液中Fe2+把Cr2O72-还原为Cr3+;根据
12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3与NaOH反应分别转化为Na2SiO3和NaAlO2,产物中只有Fe2O3难溶于水;根据过滤装置分析所需的玻璃仪器;(3)操作④中酸化时,CrO42-转化为Cr2O72-,根据元素守恒、电荷守恒配平转化的离子方程式;(4)调节溶液pH=7~8可以将硅酸根离子和偏铝酸根离子转化为沉淀而除去;(5)B电极生成氢气,所以B是阴极;阳极生成Fe2+,阳极区域溶液中Fe2+把Cr2O72-还原为Cr3+;根据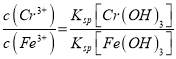 计算c(Cr3+)。
计算c(Cr3+)。
解析:(1)将铭铁矿粉碎的作用是增大接触面积,增大反应速率和提高原料的利用率;(2)反应器中主要发生6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3与NaOH反应分别转化为Na2SiO3和NaAlO2,产物中只有Fe2O3难溶于水,所以滤渣是Fe2O3;过滤所需的玻璃仪器有烧杯、漏斗、玻璃棒;(3)操作④中酸化时,CrO42-转化为Cr2O72-,根据元素守恒、电荷守恒,反应的离子方程式是2CrO42-+2H+
12Na2CrO4+3Fe2O3+7KC1+12H2O, SiO2、Al2O3与NaOH反应分别转化为Na2SiO3和NaAlO2,产物中只有Fe2O3难溶于水,所以滤渣是Fe2O3;过滤所需的玻璃仪器有烧杯、漏斗、玻璃棒;(3)操作④中酸化时,CrO42-转化为Cr2O72-,根据元素守恒、电荷守恒,反应的离子方程式是2CrO42-+2H+![]() Cr2O72-+H2O;(4)调节溶液pH=7~8可以将硅酸根离子和偏铝酸根离子转化为沉淀而除去;(5)B电极生成氢气,所以B是阴极;阳极铁失电子生成亚铁离子,电极反应式为Fe-2e-= Fe2+,阳极区域溶液中Fe2+把Cr2O72-还原为Cr3+,反应方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
Cr2O72-+H2O;(4)调节溶液pH=7~8可以将硅酸根离子和偏铝酸根离子转化为沉淀而除去;(5)B电极生成氢气,所以B是阴极;阳极铁失电子生成亚铁离子,电极反应式为Fe-2e-= Fe2+,阳极区域溶液中Fe2+把Cr2O72-还原为Cr3+,反应方程式是Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O; 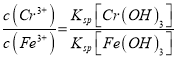 ,
, ![]() ,c(Cr3+)=1.5×10﹣5。
,c(Cr3+)=1.5×10﹣5。

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案【题目】(本题共8分)现有部分元素的性质与原子(或分子)结构如下表:
元素编号 | 元素性质与原子(或分子)结构 |
T | 最外层电子数是次外层电子数的3倍 |
X | 常温下单质为双原子分子,分子中含有3对共用电子对 |
Y | M层比K层少1个电子 |
Z | 第三周期元素的简单离子中半径最小 |
(1)写出元素T的原子结构示意图 。
(2)元素Y与元素Z相比,金属性较强的是________(用元素符号表示),下列表述中能证明这一事实的是________(填序号)。
a.Y单质的熔点比Z单质低
b.Y的化合价比Z低
c.Y单质与水反应比Z单质剧烈
d.Y最高价氧化物的水化物的碱性比Z强
(3)T、X、Y、Z中有两种元素能形成既有离子键又有非极性共价键的化合物,写出该化合物的电子式:_____ _________。
(4)元素T和氢元素可形成一种18电子的化合物Q,元素X与氢元素也能按原子个数比为1∶2形成一种18电子化合物W,Q与W发生氧化还原反应,生成X单质和T的另一种氢化物,写出该反应的化学方程式: 。
【题目】TiCl4是制备钛及其化合物的重要中间体,某小组同学利用下列装置在实验室制备TiCl4,设计实验如下(夹持装置略去):

相关信息如下表所示。
化合物 | 熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 |
TiCl4 | -25 | 136 | 1.5 | 易水解生成难溶于水的物质,能溶于有机溶剂 |
CCl4 | -25 | 76.8 | 1.6 | 难溶于水 |
请回答下列问题:
(1)按照气流由左到右的方向,上述装置合理的连接顺序为a→ → →f→g→ → →d→e→j。(填仪器接口字母)_____________
(2)根据完整的实验装置进行实验,实验步骤如下:检查装置气密性后,装入药品;__________(按正确的顺序填入下列操作的序号)。
①关闭分液漏斗活塞 ②打开分液漏斗活塞
③停止加热,充分冷却 ④加热装置D中陶瓷管
(3)装置A中导管m的作用是________________。
(4)装置D中除生成TiCl4外,同时生成一种气态不成盐氧化物,该反应的化学方程式为______________。
(5)设计实验证明装置E中收集到的液体中含有TiCl4:___________________________________。
(6)制得的TiCl4中常含有少量CCl4,从混合液体中分离出TiCl4的操作名称为__________。