题目内容
环境中常见的重金属污染物有:汞.铅.锰.铬.镉。处理工业废水中含有的 和
和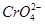 ,常用的方法有两种。
,常用的方法有两种。
方法1 还原沉淀法该法的工艺流程为
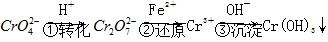 。
。
其中第①步存在平衡2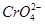 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。
(橙色)+H2O。
(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。
(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
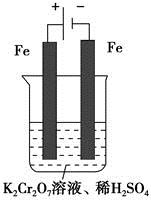
方法2 电解法
(5)实验室利用如图装置模拟电解法处理含 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
 和
和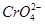 ,常用的方法有两种。
,常用的方法有两种。方法1 还原沉淀法该法的工艺流程为
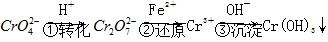 。
。其中第①步存在平衡2
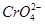 (黄色)+2H+
(黄色)+2H+
 (橙色)+H2O。
(橙色)+H2O。(1)写出第①步反应的平衡常数表达式_________________________________。
(2)关于第①步反应,下列说法正确的是________。
A.通过测定溶液的pH可以判断反应是否已达平衡状态
B.该反应为氧化还原反应
C.强酸性环境,溶液的颜色为橙色
(3)第②步中,还原0.1 mol
 ,需要________mol的FeSO4·7H2O。
,需要________mol的FeSO4·7H2O。(4)第③步除生成Cr(OH)3外,还可能生成的沉淀为________。在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。
Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=10-32,当c(Cr3+)降至10-5 mol·L-1时,认为c(Cr3+)已经完全沉淀,现将第③步溶液的pH调至4,请通过计算说明Cr3+是否沉淀完全(请写出计算过程):______________________________________________。方法2 电解法
(5)实验室利用如图装置模拟电解法处理含
 的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
的废水,电解时阳极反应式为________,阴极反应式为________,得到的金属阳离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因是________________________。
(1)
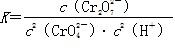 (2)AC (3)0.6
(2)AC (3)0.6(4)Fe(OH)3 当pH调至4时,c(OH-)=10-10 mol·L-1,c(Cr3+)=10-32/c3(OH-)=10-2 mol·L-1>10-5 mol·L-1,因此Cr3+没有沉淀完全
(5)Fe-2e-=Fe2+ 2H++2e-=H2↑ 阳极生成的金属阳离子向阴极移动,阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中OH-的浓度增大,溶液逐渐呈碱性
(1)稀溶液中H2O的浓度可视为常数,故第①步反应的平衡常数表达式为K=c( )/[c2(
)/[c2(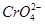 )·c2(H+)]。(2)由反应①可知,平衡发生移动,溶液的pH发生变化,故pH不变时说明反应达到平衡,A项正确;
)·c2(H+)]。(2)由反应①可知,平衡发生移动,溶液的pH发生变化,故pH不变时说明反应达到平衡,A项正确;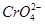 和
和 中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(
中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c( )较大,溶液呈橙色,C项正确。(3)在第②步反应中
)较大,溶液呈橙色,C项正确。(3)在第②步反应中 被还原为Cr3+,0.1 mol
被还原为Cr3+,0.1 mol  被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O。(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成。(5)电解池的阳极发生氧化反应,Fe作阳极,则Fe电极本身被氧化,故阳极反应式为Fe-2e-=Fe2+;阴极则是电解质溶液中的H+得电子,发生还原反应生成氢气,故阴极反应式为2H++2e-=H2↑;阳极生成的金属阳离子移向阴极,而阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中的OH-浓度增大,溶液逐渐呈碱性,从而使金属阳离子在阴极区形成沉淀。
被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O。(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成。(5)电解池的阳极发生氧化反应,Fe作阳极,则Fe电极本身被氧化,故阳极反应式为Fe-2e-=Fe2+;阴极则是电解质溶液中的H+得电子,发生还原反应生成氢气,故阴极反应式为2H++2e-=H2↑;阳极生成的金属阳离子移向阴极,而阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中的OH-浓度增大,溶液逐渐呈碱性,从而使金属阳离子在阴极区形成沉淀。
 )/[c2(
)/[c2(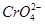 )·c2(H+)]。(2)由反应①可知,平衡发生移动,溶液的pH发生变化,故pH不变时说明反应达到平衡,A项正确;
)·c2(H+)]。(2)由反应①可知,平衡发生移动,溶液的pH发生变化,故pH不变时说明反应达到平衡,A项正确;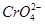 和
和 中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c(
中Cr均为+6价,该反应不是氧化还原反应,B项错误;在酸性环境中,溶液中c( )较大,溶液呈橙色,C项正确。(3)在第②步反应中
)较大,溶液呈橙色,C项正确。(3)在第②步反应中 被还原为Cr3+,0.1 mol
被还原为Cr3+,0.1 mol  被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O。(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成。(5)电解池的阳极发生氧化反应,Fe作阳极,则Fe电极本身被氧化,故阳极反应式为Fe-2e-=Fe2+;阴极则是电解质溶液中的H+得电子,发生还原反应生成氢气,故阴极反应式为2H++2e-=H2↑;阳极生成的金属阳离子移向阴极,而阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中的OH-浓度增大,溶液逐渐呈碱性,从而使金属阳离子在阴极区形成沉淀。
被还原时转移电子的物质的量为0.1 mol×2×(6-3)=0.6 mol,而还原剂Fe2+被氧化为Fe3+,故需要消耗0.6 mol FeSO4·7H2O。(4)在第②步反应中Fe2+被氧化为Fe3+,故第③步还有Fe(OH)3生成。(5)电解池的阳极发生氧化反应,Fe作阳极,则Fe电极本身被氧化,故阳极反应式为Fe-2e-=Fe2+;阴极则是电解质溶液中的H+得电子,发生还原反应生成氢气,故阴极反应式为2H++2e-=H2↑;阳极生成的金属阳离子移向阴极,而阴极反应消耗了H+,打破了水的电离平衡,促进了水的电离,使溶液中的OH-浓度增大,溶液逐渐呈碱性,从而使金属阳离子在阴极区形成沉淀。
练习册系列答案
相关题目
 4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是 ( )
4C(g),达平衡时c(A)=1.00mol?L-1,现将压强减小到1.01×105Pa,建立平衡后,c(A)=0.18mol?L-1,则下列说法正确的是 ( )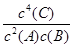
 CH3OH(g)+H2O(g),该反应的能量变化如图所示:
CH3OH(g)+H2O(g),该反应的能量变化如图所示: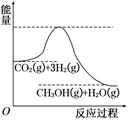
 2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量
2CH3COOH(g),经实验测得不同压强下,体系的平均摩尔质量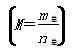 随温度(T)的变化曲线如图所示,下列说法正确的是( )
随温度(T)的变化曲线如图所示,下列说法正确的是( )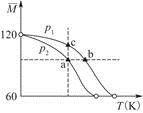
 2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是
2NH3(g)+CO2(g)。判断该分解反应已经达到化学平衡的是  CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表:
CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见下表: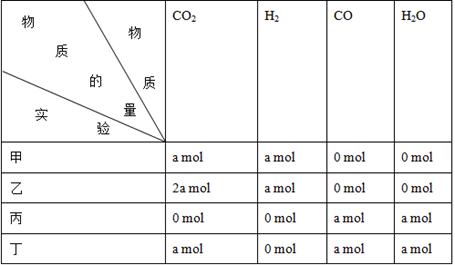
 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是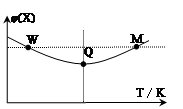
 2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )
2NO2(正反应为放热反应),不能说明已经达到平衡状态的是( )