题目内容
【题目】下列图示与对应的叙述相符的是( )
A.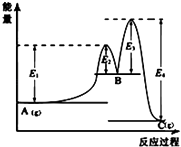
图中可以看出反应A(g)=C(g)的△H=(E1﹣E4)kJmol﹣1
B.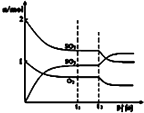
图中表示一定条件下进行的反应2SO2+O2═2SO3各成分的物质的量变化,t2时刻改变的条件可能是扩大了容器的体积
C.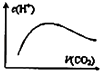
图中表示将CO2通入NaOH的稀溶液中,随着CO2的通入,溶液中水电离出的c(H+)变化关系
D.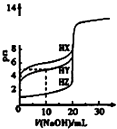
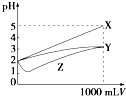
图中曲线表示用0.1000mol/L NaOH溶液分别滴定浓度相同的三种一元酸,由此可判断HX的酸性最强
【答案】C
【解析】解:A.整个反应中△H=(E1﹣E2)+(E2﹣E3)﹣E4=E1﹣E3﹣E4 , 故A错误;
B.如果t2时扩大容器的体积,则各种物质的浓度瞬间变小,浓度曲线不是连续的,故B错误;
C.NaOH溶液呈碱性对水的电离起抑制作用,水电离氢离子浓度较小,通入二氧化碳,氢氧化钠的浓度减小,对水的抑制程度较小,水电离的氢离子浓度增大,当二氧化碳过量时,二氧化碳与水反应生成碳酸又抑制水的电离,水电离的氢离子浓度减小,与图象相符合,故C正确;
D.氢氧化钠体积为0时,0.1000molL﹣1的三种酸HX、HY、HZ的PH分别约为4、2.5、1,故酸性大小为HX<HY<HZ,故D错误;
故选C.
A.A→B的反应,反应物总能量小于生成物总能量,反应吸热,B→C的反应,反应物的总能量大于生成物总能量,反应为放热反应,结合能量的高低解答该题;
B.依据图象各种物质的物质的量浓度的变化分析,改变条件后各种物质的浓度曲线是连续渐变的据此分析;
C.分析图象可知水电离产生的氢离子浓度先增加后减小,说明二氧化碳通入的过程中先产生了促进水电离的物质,后又生成了抑制水的电离的物质,结合水的电离平衡的影响因素解答;
D.依据浓度相同的三种一元酸未加氢氧化钠溶液时pH值的大小可判断酸性的强弱.