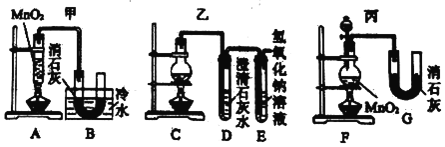
题目内容
【题目】研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。回答下列问题:
(1)CO可用于高炉炼铁。
已知:Fe3O4(s)+4CO(g)====3Fe(s)+4CO2(g) △H=akJ·mol-1
3Fe2O3(s)+CO(g)====2Fe3O4 (s)+CO2(g) △H=bkJ·mol-1
则反应Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g)的△H=____________kJ·mol-1(用含a、b的代数式表示)
(2)一定条件下,CO2和CO可以互相转化。某温度下,在容积为2L的密闭容器按甲、乙两种方式投入反应物发生反应:CO2(g)+H2(g)![]() CO(g)+H2O(g)。
CO(g)+H2O(g)。
容器 | 反应物 |
甲 | 8molCO2(g)、16molH2(g) |
乙 | ωmolCO2(g)、xmolH2(g)、ymolCO(g)、zmolH2O(g) |
甲容器15min后达到平衡,此时CO2的转化率为75%。则0~15min内平均反应速率v(H2)= ____________,该温度下反应的平衡常数K=____________。欲使平衡后乙容器与甲容器中相同气体的体积分数分别相等,则ω、x、y、z需满足的关系是y=____________,(用含x、w的代数式表示),且___________。
(3)已知反应C6H5CH2CH3(g)+CO2(g)![]() C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:
C6H5CH=CH2(g)+CO(g)+H2O(g) △H。温度、压强对乙苯的平衡转化率的影响如下图所示:

则该反应的△H___________ 0(填“>”“<”或“=”),压强p1、p2、p3从大到小的顺序是___________。
(4)CO可被NO2氧化:CO+NO2![]() CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
CO2+NO。当温度高于225℃时,反应速率v正=k正·c(CO)·c(NO2)、v逆=k逆·c(CO2)·c(NO),k正、k逆分别为正、逆反应速率常数。则k正、k逆与该反应的平衡常数K之间的关系为K=___________。
【答案】![]() 0.2 molL-1min-1 1.8 x-2w y=z > p1>p2>p3
0.2 molL-1min-1 1.8 x-2w y=z > p1>p2>p3 ![]()
【解析】
(1)由盖斯定律计算可得;
(2)由题意建立三段式计算反应速率和化学平衡常数;等效平衡符合变化量之比等于化学计量数之比;
(3)升高温度,平衡向吸热方向移动,增大压强,平衡向气体体积减小的方向移动;
(1) 将已知反应依次编号为①、②,由盖斯定律①×![]() +②×
+②×![]() 得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g),则△H=
得到Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g),则△H=![]() kJ·mol-1,故答案为:
kJ·mol-1,故答案为:![]() ;
;
(2)由CO2的转化率为75%可知,二氧化碳的变化量为4 mol/L×75%=3 mol/L,由题给数据可以建立如下三段式:
CO2(g)+H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
起(mol/L) 4 8 0 0
变(mol/L) 3 3 3 3
平(mol/L) 1 5 3 3
0~15min内平均反应速率v(H2)=![]() =
=![]() =0.2 molL-1min-1;反应的平衡常数K=
=0.2 molL-1min-1;反应的平衡常数K=![]() =
=![]() =1.8;平衡后乙容器与甲容器中相同气体的体积分数分别相等,则甲乙为等效平衡,需满足(w-y):(x-y)=8:16,由变化量之比等于化学计量数之比可得:(8—ω):(16—x):y:z=1:1:1:1,解关系式可知y=z,y= x—2w,故答案为:0.2 molL-1min-1;1.8;x—2w;y=z;
=1.8;平衡后乙容器与甲容器中相同气体的体积分数分别相等,则甲乙为等效平衡,需满足(w-y):(x-y)=8:16,由变化量之比等于化学计量数之比可得:(8—ω):(16—x):y:z=1:1:1:1,解关系式可知y=z,y= x—2w,故答案为:0.2 molL-1min-1;1.8;x—2w;y=z;
(3)由图可知,温度越高、乙苯的平衡转化率越大,说明平衡向正反应方向移动,则△H>0;该反应是一个气体体积减小的反应,增大压强,平衡向逆反应方向移动,则p1>p2>p3,故答案为:>;p1>p2>p3;
(4)反应达平衡时必然有v正=v逆,即k正·c(CO)·c(NO2)=k逆·c(CO2)·c(NO),则![]()
![]() =k,故答案为:
=k,故答案为:![]() 。
。

 名校课堂系列答案
名校课堂系列答案【题目】光气(COCl2)在塑料、制药等工业生产中有许多用途,其化学性质不稳定,遇水迅速产生两种酸性气体。回答下列问题:
(1)少量COCl2可用烧碱溶液吸收,发生反应的离子方程式为________。
(2)工业上用CO和Cl2在高温、活性炭催化作用下合成光气:Cl2(g)+CO(g)![]() COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
COCl2(g) H=-108 kJ·mol-1。所需CO来自CH4与CO2的催化重整反应。查阅文献获得以下数据:
CH4(g)+2O2(g)==CO2(g)+2H2O(l) H1=-890.3 kJ·mol-1
2H2(g)+O2 (g)==2H2O(l) H2=-571.6 kJ·mol-1
2CO(g)+O2 (g)==2CO2(g) H3=-566 kJ·mol-1
则CH4与CO2催化重整反应生成CO和H2的热化学方程式为_____。
(3)在T ℃时,向盛有活性炭的5 L恒容密闭容器中加入0.6 mol CO和0.45 mol Cl2,CO和COCl2的浓度在不同时刻的变化状况如图所示:

①反应在第6 min时的平衡常数为___,第8 min时改变的条件是____。
②在第12 min时升高温度,重新达到平衡时,COCl2的体积分数将___(填“增大”“不变”或“减小”),原因是_____。
(4)Burns和Dainton研究了反应Cl2(g)+CO(g)![]() COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
COCl2(g)的动力学,获得其速率方程v = k[c(Cl2)]3/2[c(CO)]m,k为速率常数(只受温度影响),m为CO的反应级数。
①该反应可认为经过以下反应历程:
第一步:Cl2![]() 2Cl 快速平衡
2Cl 快速平衡
第二步:Cl + CO![]() COCl 快速平衡
COCl 快速平衡
第三步:COCl + Cl2 —→COCl2 + Cl 慢反应
下列表述正确的是____(填标号)。
A.COCl属于反应的中间产物 B.第一步和第二步的活化能较高
C.决定总反应快慢的是第三步 D.第三步的有效碰撞频率较大
②在某温度下进行实验,测得各组分初浓度和反应初速度如下:
实验序号 | c(Cl2)/mol·L-1 | c(CO)/mol·L-1 | v/mol·L-1·s-1 |
1 | 0.100 | 0.100 | 1.2×10-2 |
2 | 0.050 | 0.100 | 4.26×10-3 |
3 | 0.100 | 0.200 | 2.4×10-2 |
4 | 0.050 | 0.050 | 2.13×10-3 |
CO的反应级数m =___,当实验4进行到某时刻,测得c(Cl2) = 0.010mol·L-1,则此时的反应速率v =___mol·L-1·s-1(已知:![]() ≈ 0.32)。
≈ 0.32)。