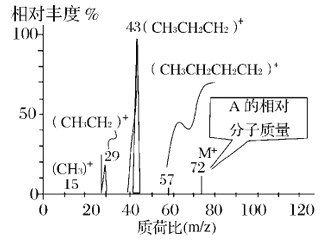
题目内容
【题目】填写下列空白:
(1) ______mol H2O中含有的氧原子数与1.5 mol CO2中含有的氧原子数相等。
(2)将等物质的量的NH3和CH4混合,混合气体中NH3与CH4的质量比为______。
(3)要使NH3与CH4含相同数目的H原子,则NH3和CH4的物质的量之比为______。
(4)标准状况下,密度为0.75 g·L1的NH3与CH4组成的混合气体中,NH3的体积分数为______,该混合气体对氢气的相对密度为______。
(5)某结晶水合物的化学式为A·nH2O,A的相对分子质量为M。如将a g该结晶水合物加热至结晶水全部失去,剩余的残渣为b g,则n=______。
(6)已知a g A和b g B恰好完全反应生成0.2 mol C和d g D,则C的摩尔质量为______。
【答案】(1)3(1分)
(2)17∶16(1分)
(3)4∶3
(4)80% 8.4
(5)![]()
(6)5(a+bd) g·mol1
【解析】(4)![]() =0.75 g·L1×22.4 L·mol1=16.8 g·mol1。设NH3的物质的量为x,CH4的物质的量为y,则
=0.75 g·L1×22.4 L·mol1=16.8 g·mol1。设NH3的物质的量为x,CH4的物质的量为y,则![]() =16.8 g·mol1,x∶y=4∶1,NH3的体积分数为
=16.8 g·mol1,x∶y=4∶1,NH3的体积分数为![]() ×100%=80%,该混合气体对H2的相对密度为
×100%=80%,该混合气体对H2的相对密度为![]() =8.4。
=8.4。
(5)A·nH2O![]() A+nH2O
A+nH2O
M+18n M
a g b g
(M+18n)∶M=a∶b
解得n=![]() 。
。
(6)依据质量守恒定律有a g+b g=0.2 mol·M(C)+d g,解得M(C)=5(a+bd) g·mol1。

 全能测控期末小状元系列答案
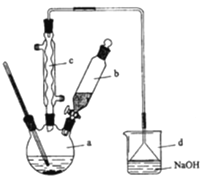
全能测控期末小状元系列答案【题目】溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按以下合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑。在b中小心加入4.0mL液态溴.向a中滴入几滴溴,有白雾产生,是因为生成了_________气体,继续滴加至液溴滴完。装置d的作用是_________;
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤.NaOH溶液洗涤的作用是_________;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.加入氯化钙的目的是_________;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为_________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是_____________(填入正确选项前的字母):
A.25mL B.50mL C.250mL D.500mL
【题目】钴(Co)是重要的稀有金属,在工业和科技领域具有广泛的用途。从某含钴工业废料中回收钴的工艺流程如下:
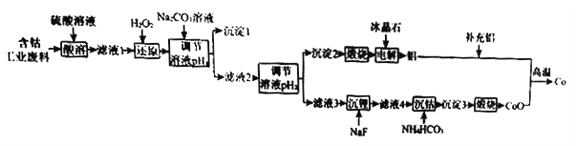
已知:
含钴废料的成分 | |||||
成分 | Al | Li | Co2O3 | Fe2O3 | 其他不溶于强酸的杂质 |
质量分数/% | 10.5 | 0.35 | 65.6 | 9.6 | 13.95 |
Ⅱ.实验中部分离子开始沉淀和沉淀完全的pH | |||
金属离子 | Fe3+ | Co2+ | Al3+ |
开始沉淀的pH | 1.9 | 7.15 | 3.4 |
沉淀完全的pH | 3.2 | 9.15 | 4.7 |
Ⅲ.离子浓度小于等于1.0×10-5 mol·L-1时,认为该离子沉淀完全。
请回答下列问题:
(1)NaF的电子式为____________。
(2)“沉淀1”的化学式为____________________。“调节溶液pH2”的范围为_________________。
(3)“还原”时发生反应的离子方程式为_______________________。
“沉钴”时发生反应的离子方程式为________________________。
(4)制备Co时,“补充铝”的原因为_________________________。
(5)已知:l0-0.9≈0.13,则 A1(OH)3 的溶度积常数 Ksp=_____________________。
(6)Li-SOCl2电池可用于心脏起搏器,该电池的总反应可表示为::4Li+2SOCl2=4LiCl+S+SO2,其正极反应式为_____________