题目内容
(4分)利用氧化还原反应原理配平
⑴ NH3 + O2 NO + H2O
NO + H2O
⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
⑴ NH3 + O2
 NO + H2O
NO + H2O ⑵ FeSO4 + KNO3 + H2SO4 = K2SO4 + Fe2(SO4)3 + NO↑+ H2O
(1) 4 5 4 6 (2)6 2 4 3 2 4
略

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
 应中氧化剂与还原剂的物质的量之比为1∶2的反应是
应中氧化剂与还原剂的物质的量之比为1∶2的反应是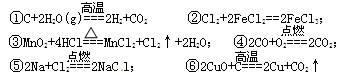
 (填化学式),
(填化学式), 被氧化的元素是________(填元素符号)。
被氧化的元素是________(填元素符号)。 :3
:3