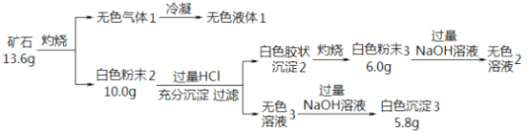
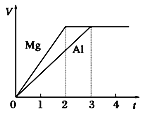
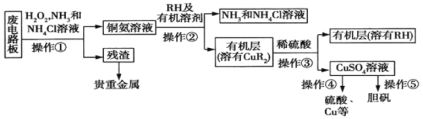
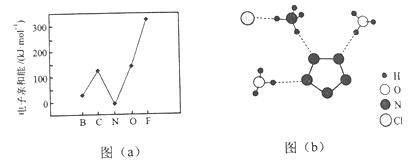
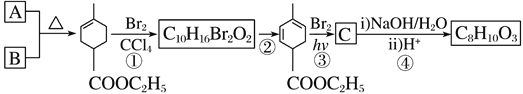
��Ŀ����
����Ŀ����.�������а������ʣ���ʳ�ξ��壻���Ҵ����۱����ᣨ�����ᾧ�壩����NaHSO4����KNO3��Һ�������ڵ��������ƣ���Һ̬�Ȼ��⣻��Cl2��
��1����ջش����������
a�������������ڷǵ���ʵ���______��
b���������ʿ��Ե������________��
��2��д��������ˮʱ�ĵ��뷽��ʽ________��
��.��Ҫ��ش���������:
��1����������CO2��CO����������ķ�����֮��Ϊ_____��
��2��ʵ������ʢ������������Һ���Լ�ƿƿ�������ò������������ӷ���ʽ��ʾ���е�ԭ��_____��
��3���ҹ�����Ϊ��������ȱ�������涨��ʳ���б�����������ĵ���ء�����ʳ�����Ƿ�ӵ⣬���������·�Ӧ��KIO3 +KI+H2SO4 = K2SO4+ I2+H2O��
�ٽ�����������ԭ��Ӧ�Ļ�ѧ����ʽ��ƽ___��
�������Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ_______mol��
���𰸡��� �ݢ� NaHSO4=Na++H++SO42- 7:11 SiO2+2OH-=SiO32-+H2O 1��5��3��3��3��3 0.3mol
��������
���ʳ�ξ������ڵ���ʣ����ܵ��磻���Ҵ����ڷǵ���ʣ����ܵ��磻�������ᣨ�����ᾧ�壩���ڵ���ʣ����ܵ��磻��NaHSO4���ڵ���ʣ����ܵ��磻��KNO3��Һ���ڵ������Һ���ܵ��磻�����ڵ������������ڵ���ʣ��ܵ��磻��Һ̬�Ȼ������ڵ���ʣ����ܵ��磻��Cl2���ǵ����Ҳ���Ƿǵ���ʣ����ܵ��磻�ó����ۡ�
��������ˮʱ�ĵ��뷽��ʽ��NaHSO4 = Na++H++SO42����
���ŵ�������CO2��CO��������֮�ȵ������ʵ���֮�ȣ�![]() ��������ȣ����ʵ�����Ħ�������ʷ��ȣ�
��������ȣ����ʵ�����Ħ�������ʷ��ȣ�![]() �������������ķ�����֮��Ϊ7:11��
�������������ķ�����֮��Ϊ7:11��
��ʵ������ʢ������������Һ���Լ�ƿƿ�������ò��������������Ͷ������跴Ӧ���ɹ������ˮ��
����KIO3�е⻯�ϼ۽���5�ۣ�KI�е⻯�ϼ�����1�ۣ����������غ������ƽ��KIO3 +5KI+3H2SO4 =3 K2SO4+3I2+3H2O��
����Ӧ����ʽת��5mol���ӣ�����3mol���ʵ⣬��˷�Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ0.3mol��
���ʳ�ξ������ڵ���ʣ����ܵ��磻���Ҵ����ڷǵ���ʣ����ܵ��磻�������ᣨ�����ᾧ�壩���ڵ���ʣ����ܵ��磻��NaHSO4���ڵ���ʣ����ܵ��磻��KNO3��Һ���ڵ������Һ���ܵ��磻�����ڵ������������ڵ���ʣ��ܵ��磻��Һ̬�Ȼ������ڵ���ʣ����ܵ��磻��Cl2���ǵ����Ҳ���Ƿǵ���ʣ����ܵ��硣
��a�������������ڷǵ���ʵ�������b���������ʿ��Ե�������ݢ����ʴ�Ϊ�������ݢ���
��������ˮʱ�ĵ��뷽��ʽ��NaHSO4 = Na++H++SO42�����ʴ�Ϊ��NaHSO4 = Na++H++SO42����
���ŵ�������CO2��CO��������֮�ȵ������ʵ���֮�ȣ�![]() ��������ȣ����ʵ�����Ħ�������ʷ��ȣ�
��������ȣ����ʵ�����Ħ�������ʷ��ȣ�![]() �������������ķ�����֮��Ϊ7:11���ʴ�Ϊ��7:11��
�������������ķ�����֮��Ϊ7:11���ʴ�Ϊ��7:11��
��ʵ������ʢ������������Һ���Լ�ƿƿ�������ò��������������Ͷ������跴Ӧ���ɹ������ˮ�����ӷ���ʽ��ʾ���е�ԭ��SiO2+2OH-=SiO32��+H2O���ʴ�Ϊ��SiO2+2OH-=SiO32��+H2O��
����KIO3�е⻯�ϼ۽���5�ۣ�KI�е⻯�ϼ�����1�ۣ����������غ������ƽ��KIO3 +5KI+3H2SO4 =3 K2SO4+3I2+3H2O���ʴ�Ϊ��1��5��3��3��3��3��
����Ӧ����ʽת��5mol���ӣ�����3mol���ʵ⣬��˷�Ӧ��ת��0.5mol���ӣ�������I2�����ʵ���Ϊ0.3mol���ʴ�Ϊ��0.3��