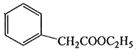
题目内容
【题目】在Na+的物质的量浓度为0.5 molL1的某澄清溶液中,还可能含有如下离子:K+、Mg2+、Ba2+、![]() 、
、![]() 、
、![]() 。取100 mL该溶液进行如下实验(气体体积在标准状况下测定):
。取100 mL该溶液进行如下实验(气体体积在标准状况下测定):
I.向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体(不考虑气体溶解);
II.向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33 g;
下列说法正确的是
A.一定不存在的离子是Mg2+、Ba2+,不能确定是否含有K+、![]()
B.一定存在的离子是![]() 、
、![]() ,
,![]() 的物质的量浓度为0.25 molL1,
的物质的量浓度为0.25 molL1,![]() 的物质的量浓度为0.1 molL1
的物质的量浓度为0.1 molL1
C.一定存在的离子是![]() 、
、![]() 、K+,其中K+浓度≥0.2 molL1
、K+,其中K+浓度≥0.2 molL1
D.一定存在的离子是![]() 、
、![]() 、K+,其中K+浓度为0.2 molL1
、K+,其中K+浓度为0.2 molL1
【答案】C
【解析】本题考查离子的检验。由向该溶液中加入足量稀盐酸,在标准状况下放出0.56 L气体,溶液中一定含有![]() ,其浓度为0.56 L÷22.4 L/mol÷0.1 L=0.25 mol/L,因含有
,其浓度为0.56 L÷22.4 L/mol÷0.1 L=0.25 mol/L,因含有![]() ,澄清溶液中一定不含有Mg2+、Ba2+;向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33 g,则溶液中一定含有
,澄清溶液中一定不含有Mg2+、Ba2+;向I中所得的滤液中滴加足量BaCl2溶液产生白色沉淀2.33 g,则溶液中一定含有![]() ,浓度为2.33 g÷233 g/mol÷0.1 L=0.1 mol/L;根据电荷守恒,0.25 mol/L×2+0.1 mol/L×2>0.5 mol/L,澄清溶液中一定含有除钠外的阳离子,所以一定含有K+,不能确定是否含有
,浓度为2.33 g÷233 g/mol÷0.1 L=0.1 mol/L;根据电荷守恒,0.25 mol/L×2+0.1 mol/L×2>0.5 mol/L,澄清溶液中一定含有除钠外的阳离子,所以一定含有K+,不能确定是否含有![]() 。A.由上分析,含有K+,故A错误;B.由上分析,一定存在的离子是
。A.由上分析,含有K+,故A错误;B.由上分析,一定存在的离子是![]() 、
、![]() 、K+,故B错误;C.一定存在的离子是
、K+,故B错误;C.一定存在的离子是![]() 、
、![]() 、K+,其中K+浓度≥0.25mol/L×2+0.1mol/L×20.5 mol/L=0.2 mol/L,故C正确;D.由于可能含有
、K+,其中K+浓度≥0.25mol/L×2+0.1mol/L×20.5 mol/L=0.2 mol/L,故C正确;D.由于可能含有![]() ,故D错误。故答案为C。
,故D错误。故答案为C。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案【题目】苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用下列装置制取高纯度的苯甲酸甲酯。
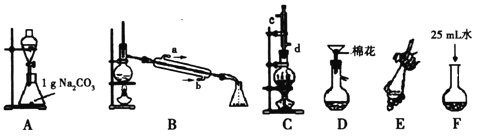
有关数据如下表:
熔点/℃ | 沸点/℃ | 密度/g·cm-3 | 水溶性 | |
苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
甲醇 | -97 | 64.3 | 0.79 | 互溶 |
苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
(1)在烧瓶中混合有机物及浓硫酸的方法是__________________________________,在实际实验中,甲醇、苯甲酸的物质的量之比远大于理论上物质的量之比,目的是_______________。装置C中除甲醇、苯甲酸与浓硫酸外还需要放置____________________________。
(2)B装置需加热的玻璃仪器的名称__________,C装置上部的冷凝管的主要作用是_____________________。冷却剂在冷凝管中的流动方向是__________。
(3)制备和提纯苯甲酸甲酯的操作先后顺序为(填装置字母代号)________________。
(4)A中Na2CO3的作用是_____________________;D装置的作用是_______________;当B装置中温度计显示_____________℃时可收集苯甲酸甲酯。