题目内容
【题目】(15分)重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质.制备流程如图所示: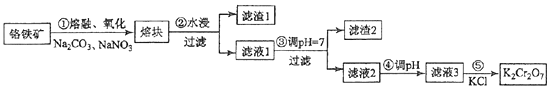
回答下列问题:
(1)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
Na2CrO4+Fe2O3+CO2+NaNO2上述反应配平后FeOCr2O3与NaNO3的系数比为 . 该步骤不能使用陶瓷容器,原因是 .
(2)滤渣1中含量最多的金属元素是 , 滤渣2的主要成分是及含硅杂质.
(3)步骤④调滤液2的pH使之变(填“大”或“小”),原因是(用离子方程式表示).
(4)有关物质的溶解度如图所示.
向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体.冷却到(填标号)得到的K2Cr2O7固体产品最多.
a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是 .
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 .
【答案】
(1)2:7;二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳
(2)Fe;Al(OH)3
(3)小;CrO42﹣+2H+?Cr2O72﹣+H2O
(4)c;复分解反应
(5)![]()
×100%
【解析】解:(1)由上述分析可知步骤①的主要反应为2FeOCr2O3+4Na2CO3+7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 则FeOCr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,
4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 则FeOCr2O3与NaNO3的系数比为2:7,该步骤不能使用陶瓷容器,原因是二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,
故答案为:2:7;二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳;(2)由上述分析可知,滤渣1含Fe2O3 , 滤渣1中含量最多的金属元素是Fe,滤渣2的主要成分是Al(OH)3及含硅杂质,
故答案为:Fe;Al(OH)3;(3)④中调节pH发生CrO42﹣+2H+Cr2O72﹣+H2O,则步骤④调滤液2的pH使之变小,增大氢离子浓度,平衡正向移动,利于生成Cr2O72﹣ ,
故答案为:小;CrO42﹣+2H+Cr2O72﹣+H2O;(4)向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体,由溶解度可知,冷却到40℃K2Cr2O7固体的溶解度在四种物质中最小、且溶解度较大,过滤分离产品最多;步骤⑤发生Na2Cr2O7+2KCl=K2Cr2O7↓+2NaCl,反应类型是复分解反应,
故答案为:c;复分解反应;(5)用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7 , 最终得到产品 m2 kg,产率为 ![]() ,由Cr原子守恒可知,则产率为
,由Cr原子守恒可知,则产率为 ![]() ×100%,
×100%,
故答案为: ![]() ×100%.
×100%.
铬铁矿的主要成分为FeOCr2O3 , 还含有硅、铝等杂质,制备重铬酸钾,由制备流程可知,步骤①的主要反应为FeOCr2O3+Na2CO3+NaNO3 ![]() Na2CrO4+Fe2O3+CO2+NaNO2 , Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FeOCr2O3+4Na2CO3+7NaNO3
Na2CrO4+Fe2O3+CO2+NaNO2 , Cr元素的化合价由+3价升高为+6价,Fe元素的化合价由+2价升高为+3价,N元素的化合价由+5价降低为+3价,由电子、原子守恒可知,反应为2FeOCr2O3+4Na2CO3+7NaNO3 ![]() 4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3 , 滤液1中含NaAlO2、Na2CrO4 , 调节pH过滤分离出Al(OH)3、Si,滤液2中含Na2CrO4 , ④中调节pH发生CrO42﹣+2H+Cr2O72﹣+H2O,滤液3含Na2Cr2O7 , 由水中的溶解度:Na2Cr2O7>K2Cr2O7 , 可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7 , 溶解度小的析出,以此来解答.
4Na2CrO4+Fe2O3+4CO2+7NaNO2 , 该步骤中若使用陶瓷,二氧化硅与碳酸钠高温下反应生成硅酸钠和二氧化碳,则使用铁坩埚,熔块水浸过滤分离出滤渣1含Fe2O3 , 滤液1中含NaAlO2、Na2CrO4 , 调节pH过滤分离出Al(OH)3、Si,滤液2中含Na2CrO4 , ④中调节pH发生CrO42﹣+2H+Cr2O72﹣+H2O,滤液3含Na2Cr2O7 , 由水中的溶解度:Na2Cr2O7>K2Cr2O7 , 可知⑤中向Na2Cr2O7溶液中加入KCl固体后得到K2Cr2O7 , 溶解度小的析出,以此来解答.