题目内容
【题目】科学家为实现“低碳”构想,把空气中的CO2转化为可再生能源甲醇(CH3OH).该反应的热化学方程式为: CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H
(1)若在一个定温定容的容器中发生上述反应,反应达到平衡的标志是 . (填编号)
A.H2O(g)和CH3OH(g)的浓度相等
B.H2的百分含量保持不变
C.容器内压强保持不变
D.v (H2)=3v (H2O)
E.容器中混合气体的密度保持不
(2)若将CO2和H2的混合气体分成五等份,将它们分别充入温度不同、容积相同的恒容容器中发生上述反应.反应相同时间后,测得甲醇的体积分数Φ(CH3OH)与反应温度T的关系如图1,则上述CO2转化为甲醇的反应的平衡常数表达式为 , 升高温度该平衡常数(填“增大”、“减小”、“不变”) 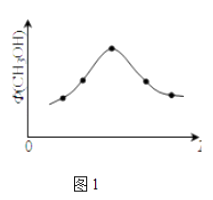
(3)300℃时,将CO2与H2按1:3的体积比充入某密闭容器中,CO2的平衡转化率(α)与体系总压强(P)的关系如图2所示.回答下列问题: 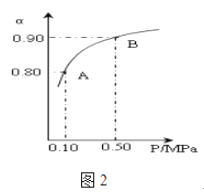
①若其他条件不变,将A点的体积压缩至原来的一半,一段时间后反应再次达到平衡,与原平衡相比较下列说法正确的是 . (填编号)
A.CO2的浓度减小
B.正反应速率增大,逆反应速率减小
C.CO2和H2的体积比仍然是1:3
D.H2的体积分数减小
②A点平衡混合气体的平均摩尔质量为(保留一位小数).
【答案】
(1)BC
(2)K= ![]() ;减小
;减小
(3)CD;20.8g/mol
【解析】解:(1)A.CO2和CH3OH的浓度相等,并不是不变,所以不能说明达平衡状态,故错误;B.H2的百分含量保持不变,说明各物质的量不变,反应达平衡状态,故正确;C.容器内压强保持不变,说明气体的总物质的量不变,反应达平衡状态,故正确;D.达平衡时应有:v正(H2)=3v逆(H2O),故错误;E.容器中混合气体的密度一直保持不变,故错误;BC;(2)平衡常数表达式为生成物浓度的幂次方之积比上反应物浓度的幂次方之积,则CO2(g)+3H2(g)CH3OH(g)+H2O(g)的平衡常数的表达式为:K= ![]() ;由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,则平衡常数减小, 所以答案是:K=
;由图可知最高点反应到达平衡,达平衡后,温度越高,φ(CH3OH)越小,平衡向逆反应进行,则平衡常数减小, 所以答案是:K= ![]() ;减小;(3)①A.体积压缩,反应混合物各组分浓度均增大,故A错误;B.体积压缩,压强增大,正、逆反应速率都增大,故B错误;C.CO和H2按1:3的体积比投入,且二者按物质的量1:3反应,反应体系中CO2和H2的体积比始终为1:3,故C正确;D.压缩体积,增大压强,平衡正向移动,H2的体积分数减小,故D正确,
;减小;(3)①A.体积压缩,反应混合物各组分浓度均增大,故A错误;B.体积压缩,压强增大,正、逆反应速率都增大,故B错误;C.CO和H2按1:3的体积比投入,且二者按物质的量1:3反应,反应体系中CO2和H2的体积比始终为1:3,故C正确;D.压缩体积,增大压强,平衡正向移动,H2的体积分数减小,故D正确,
故选:CD;②由CO2与H2按1:3的体积比,设二氧化碳的物质的量为1mol,则氢气的物质的量为3mol,而平衡时CO2的平衡转化率80%,
CO2(g)+ | 3H2(g)→ | CH3OH(g)+ | H2O(g) | |
起始(mol) | 1 | 3 | 0 | 0 |
转化(mol) | 0.8 | 2.4 | 0.8 | 0.8 |
平衡(mol) | 0.2 | 0.6 | 0.8 | 0.8 |
所以B点平衡混合气体的平均摩尔质量为 ![]() =20.8g/mol,
=20.8g/mol,
所以答案是:20.8g/mol.
【考点精析】掌握化学平衡状态的判断是解答本题的根本,需要知道状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.