题目内容
(14分)利用废铁丝、硫酸铜废液(含硫酸亚铁)和被有机物污染的废铜粉制备硫酸铜晶体。生产过程如下:

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有 。
(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
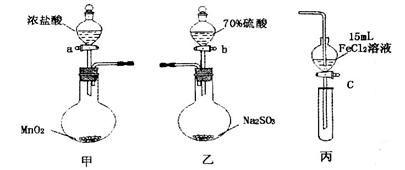
在实验室中,常将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。
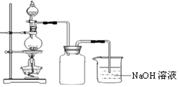
(3)写出烧瓶中发生反应的离子方程式为
(4)广口瓶的作用是
(5)为符合绿色化学的要求,某研究性学习小组进行如下
设计:将3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入18 mL 10%的H2O2,反应0.5h后,升温到60 ℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5 g。请回答:
①加热时温度不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。

试回答下列问题:
(1)铁丝在投入硫酸铜废液前需用稀H2SO4进行处理,可能发生反应的离子方程式有 。
(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是(用化学反应方程式表示) 。
在实验室中,常将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图所示)。

(3)写出烧瓶中发生反应的离子方程式为
(4)广口瓶的作用是
(5)为符合绿色化学的要求,某研究性学习小组进行如下
设计:将3.2 g铜丝放到45 mL 1.5 mol·L-1的稀硫酸中,控温在50 ℃。加入18 mL 10%的H2O2,反应0.5h后,升温到60 ℃,持续反应1 h后,过滤、蒸发浓缩、减压抽滤等,用少量95%的酒精淋洗后晾干,得CuSO4·5H2O 10.5 g。请回答:
①加热时温度不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
⑴ Fe2O3+6H+=2Fe3++3H2O,2Fe3++Fe=3Fe2+,Fe+2H+=Fe2++H2↑;
⑵ 2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;
⑶ 3Cu+8H++3NO3- =3Cu2++2NO↑+4H2O ;
⑷ 安全瓶 ;⑸ ①防止双氧水分解 ;②84% 。
⑵ 2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;
⑶ 3Cu+8H++3NO3- =3Cu2++2NO↑+4H2O ;
⑷ 安全瓶 ;⑸ ①防止双氧水分解 ;②84% 。
试题分析:(1)铁丝表面有铁锈。投入稀H2SO4中发生反应的两种方程式为:Fe2O3+6H+=2Fe3++3H2O;2Fe3++Fe=3Fe2+;Fe+2H+=Fe2++H2↑;(2)为了使灼烧后的氧化铜混合物充分酸溶,在加入稀H2SO4的同时,还通入O2。通入O2的目的是使Cu变为氧化铜,与酸反应得到CuSO4.反应的方程式为:2Cu+O2+2H2SO4=2CuSO4+2H2O 或2Cu+O2=2CuO,CuO+H2SO4=CuSO4+H2O ;(3)在烧瓶中Cu与稀硝酸发生反应的离子方程式为:3Cu+8H++3NO3- =3Cu2++2NO↑+4H2O ;(4)广口瓶的作用是安全瓶,防止倒吸现象的发生;(5)①加热时温度不宜过高是由于在反应的过程中使用了H2O2,而H2O2受热容易分解,使用温度不宜过高。②n(Cu)=" 3.2" g÷64g/mol=0.05mol,n(H2SO4)=" 0.045" L×1.5 mol/L=" 0.0675" mol硫酸过量,所以产生的CuSO4按照Cu来计算,理论产量:0.05mol×250g/mol=12.5g。因此CuSO4·5H2O的产率为(10.5 g÷12.5g)×100%=84%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 下列说法正确的是
下列说法正确的是


 。
。