题目内容
【题目】![]() 在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为
在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为![]() ,另有少量Pb、
,另有少量Pb、![]() 和
和![]() 等)为原料制备
等)为原料制备![]() 的一种工艺流程如图所示:
的一种工艺流程如图所示:
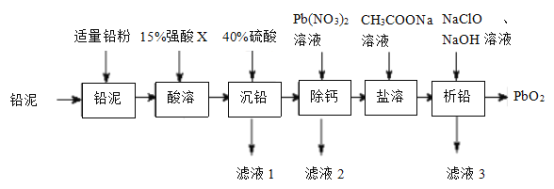
已知:i.常温下,单质铅与盐酸或硫酸几乎都不反应。
ii.铅盐中,(CH3COO)2Pb、Pb(NO3)2均易溶于水,![]() 难溶于水。
难溶于水。
请回答下列问题:
(1)“酸溶”时,Pb和PbO2转化为可溶性Pb2+盐,则“酸溶”时所用的强酸X为____;此条件下的氧化性:X___PbO2(选填“>”或“<”)
(2)用Pb(NO3)2溶液反复多次洗涤沉淀,以达到“除钙”的目的,其原理是_____________。
(3)(CH3COO)2Pb属于__________(选填“强电解质”或“弱电解质”);“滤液3”中除CH3COONa和NaClO外,所含钠盐主要还有___________(填化学式)
(4)“析铅”反应的离子方程式为____________________。
(5)从环境保护的角度分析,该工艺流程可能存在的缺点是_______________(任写一条)
(6)铅蓄电池中的电解液是H2SO4,放电后两个电极上均沉积有PbSO4。则放电时的负极反应式为___;充电时当电极上通过1mol电子,阳极的质量减少__________g。
【答案】硝酸(或HNO3); < PbSO4比CaSO4更难溶解,加入Pb(NO3)2溶液,可使CaSO4不断转化为PbSO4,Ca2+进入到溶液中 弱电解质 NaCl、Na2SO4 (CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O “酸溶”时会产生大气污染物NOx(重金属铅盐可污染土壤或水源) Pb+SO42--2e-=PbSO4 32
【解析】
(1)“酸溶”的目的是将Pb、PbO2转化为可溶性Pb2+,而常温下,单质铅与盐酸或硫酸几乎都不反应,故所用的强酸应为硝酸;在有硝酸存在的环境下,PbO2转化为Pb2+,表现出氧化性,说明PbO2的氧化性比硝酸强,故答案为:硝酸(或HNO3);<;
(2)CaSO4的溶解平衡:CaSO4(s)![]() Ca2+(aq)+SO42-(aq),加入Pb(NO3)2溶液,Pb2+与SO42-结合成更难溶的PbSO4,使CaSO4的溶解平衡不断正向移动,最终完全溶解,达到“除钙”的目的,故答案为:PbSO4比CaSO4更难溶解,加入Pb(NO3)2溶液,可使CaSO4不断转化为PbSO4,Ca2+进入到溶液中;
Ca2+(aq)+SO42-(aq),加入Pb(NO3)2溶液,Pb2+与SO42-结合成更难溶的PbSO4,使CaSO4的溶解平衡不断正向移动,最终完全溶解,达到“除钙”的目的,故答案为:PbSO4比CaSO4更难溶解,加入Pb(NO3)2溶液,可使CaSO4不断转化为PbSO4,Ca2+进入到溶液中;
(3)“盐溶”时,加入CH3COONa可使PbSO4的溶解平衡正向移动,转化为(CH3COO)2Pb,说明(CH3COO)2Pb是弱电解质;“盐溶”后,溶液中含有(CH3COO)2Pb和Na2SO4,接下来“析铅”,加入NaClO、NaOH溶液,(CH3COO)2Pb转化为PbO2,Pb元素的化合价升高,推知NaClO转化为NaCl,Cl元素的化合价降低,因此“滤液3”中除CH3COONa和NaClO外,所含钠盐主要还有NaCl和Na2SO4,故答案为:弱电解质;NaCl、Na2SO4;
(4)“析铅”反应的离子方程式为:(CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O,故答案为:(CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O;
(5)“酸溶”阶段加入的HNO3会转化为NOx污染环境,铅是重金属,铅盐也会污染土壤或水源,故答案为:“酸溶”时会产生大气污染物NOx(重金属铅盐可污染土壤或水源);
(6)铅蓄电池的负极为Pb,放电时负极发生的反应为:Pb+SO42--2e-=PbSO4;充电时阳极发生反应:PbSO4-2e-+2H2O=PbO2+SO42-+4H+,当电极上通过1mol电子,阳极上有0.5molPbSO4转化为0.5molPbO2,质量减少32g,故答案为:Pb+SO42--2e-=PbSO4;32。

 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
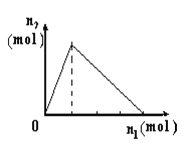
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D