题目内容
20.将9.5g MgCl2溶于水配成500mL溶液:(1)上述MgCl2溶液的物质的量浓度为多少?
(2)取出上述溶液50mL加入0.5mol•L-1的AgNO3溶液使其中的Cl-恰好全部沉淀,则需要AgNO3溶液的体积为多少mL?
分析 根据n=$\frac{m}{M}$计算9.5gMgCl2的物质的量,再根据c=$\frac{n}{V}$计算氯化镁溶液的浓度;
溶液是均匀的,从中取出50mL溶液,其中Cl-的浓度与原溶液相同,溶液中c(Cl-)=2c(MgCl2),而AgNO3溶液使其中的Cl-恰好全部沉淀,则n(AgNO3)=n(Cl-),由此分析解答.
解答 解:9.5gMgCl2的物质的量=$\frac{9.5g}{95g/mol}$=0.1mol,故氯化镁溶液的浓度为$\frac{0.1mol}{0.5L}$=0.2mol/L;
溶液是均匀的,从中取出50mL溶液,其中Cl-的浓度与原溶液相同,溶液中c(Cl-)=2c(MgCl2)=2×0.2mol/L=0.4mol/L;所以n(AgNO3)=n(Cl-)=0.4mol/L×0.05=0.02mol,所以需要AgNO3溶液的体积为$\frac{0.02mol}{0.5mol•{L}^{-1}}×1000mL/L$=40mL,
答:(1)上述MgCl2溶液的物质的量浓度为0.2mol/L;
(2)取出上述溶液50mL加入0.5mol•L-1的AgNO3溶液使其中的Cl-恰好全部沉淀,则需要AgNO3溶液的体积为40mL.
点评 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
10.设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 常温常压下,3.2 g O3所含电子数为1.2 NA | |
| B. | 标准状况下,2.24 L CCl4中含有的C-Cl键的数目为0.4 NA | |
| C. | CO与N2互为等电子体,标准状况下11.2 L CO与0.5 molN2所含电子数相等 | |
| D. | 将0.1 mol 氯化铁溶于1 L水中,所得溶液含有0.1 NA Fe3+ |
11.下列实验方案能达到预期目的是( )
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂.
①实验室保存FeCl3溶液应加少量稀盐酸,并且放入少量的Fe粉
②氢氧化钠溶液保存在配有橡胶塞的细口瓶中
③向溶液中滴入氯化钡溶液,再加稀硝酸能检验溶液中是否含有SO42-
④用丁达尔现象可以区分食盐水和淀粉溶液
⑤工业上可用金属铝与V2O5在高温下冶炼矾,铝作还原剂.
| A. | ②④⑤ | B. | ①②⑤ | C. | ①②④ | D. | ②③④ |
5.下列说法正确的是( )
| A. | 升高温度能使化学反应速率增大,主要原因是增加了反应物分子中活化分子百分数 | |
| B. | 有气体参加的化学反应若增大压强(即缩小反应容器的体积),可增加反应物分子中活化分子的百分数从而使反应速率增大 | |
| C. | 增大反应物浓度可增大单位体积内活化分子的百分数,从而使有效碰撞次数增加 | |
| D. | 催化剂不影响反应的活化能,但能增大单位体积内活化分子百分数,增大反应速率 |
12.下列说法不正确的是( )
| A. | 氯气可用于自来水的消毒 | B. | 二氧化硅是半导体材料 | ||
| C. | 氢氧化铁胶体能用于净水 | D. | 二氧化硫可用于漂白纸浆 |
9.认真审题,完成下列实验探究.
(1)探究潮湿氯气与碳酸钠反应的产物
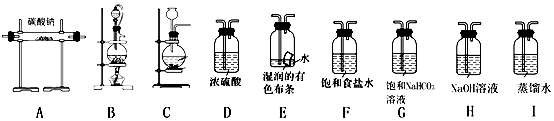
①选择必要的仪器,按BFAH顺序连接好装置(填装置序号).
②写出在该实验情境下,制备氯气的化学方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③将A中充分反应后的固体物质分成两等份分装于两支试管中.
向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,由此现象推断固体产物中含有NaHCO3;向另一支试管中滴加过量的稀HNO3,再滴加AgNO3溶液,溶液变浑浊,由此现象推断固体产物中含有NaCl;
又已知A中反应还生成黄红色的Cl2O气体,请结合上述成分分析过程,写出潮湿的Cl2和Na2CO3的化学方程式2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O.
(2)二氧化碳与过氧化钠反应探究.
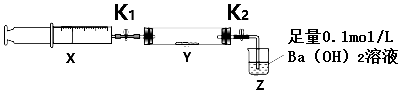
将一定量(过量)二氧化碳充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按如图示装置进行实验.
(1)探究潮湿氯气与碳酸钠反应的产物

①选择必要的仪器,按BFAH顺序连接好装置(填装置序号).
②写出在该实验情境下,制备氯气的化学方程式MnO2+4HCl$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
③将A中充分反应后的固体物质分成两等份分装于两支试管中.
向其中一支试管中加蒸馏水至固体完全溶解后,滴加BaCl2溶液,无明显现象,再滴加NaOH溶液变浑浊,由此现象推断固体产物中含有NaHCO3;向另一支试管中滴加过量的稀HNO3,再滴加AgNO3溶液,溶液变浑浊,由此现象推断固体产物中含有NaCl;
又已知A中反应还生成黄红色的Cl2O气体,请结合上述成分分析过程,写出潮湿的Cl2和Na2CO3的化学方程式2Cl2+2Na2CO3+H2O=2NaCl+2NaHCO3+Cl2O.
(2)二氧化碳与过氧化钠反应探究.
将一定量(过量)二氧化碳充入注射器X中,硬质玻璃管Y中加入少量过氧化钠,两端用夹子K1、K2夹好.在室温下按如图示装置进行实验.

| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中(假设充分反应) | ①淡黄色固体变为白色粉末 | ②反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2 |
| 将注射器活塞退回原处并固定,待装置恢复到室温,打开K2 | ③Z中液体出现倒吸 | ④不用解释 |
10.下列物质在水溶液中的电离方程式书写正确的是( )
| A. | KClO3═K++3O2-+Cl5+ | B. | NaHCO3═Na++H++CO32- | ||
| C. | H2SO4═H++SO42- | D. | Al2(SO4)3═2Al3++3SO42- |
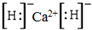 ;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.
;这种离子化合物可与水反应,化学方程式为CaH2+2H2O=Ca(OH)2+2H2↑.